Struttura e funzione delle glicoproteine
Gli oligosaccaridi si legano alle proteine mediante due sistemi diversi: i legami N (attraverso un atomo di azoto) o i legami O (attraverso un atomo di ossigeno). Nei legami N-glicosidici, un residuo NAG è invariabilmente legato (legame di tipo β) all'atomo di azoto amidico di un residuo di Asn nella sequenza Asn-X-Ser oppure Asn-X-Thr, dove X rappresenta qualsiasi residuo amminoacidico eccetto Pro, o Asp. Gli oligosaccaridi che utilizzano questo tipo di legame hanno di solito un nucleo caratteristico (la sequenza più interna), i cui residui periferici di mannosio sono legati ad altri residui di mannosio o di NAG. A loro volta, questi residui possono essere legati ad altri residui saccaridici, in modo da creare la grande diversità tra questi oligosaccaridi N-legati. Il più comune legame O-glicosidico, invece, coinvolge in nucleo disaccaridico β-galattosil-(1→3)-α-N-acetilgalattosammina legato (con legame di tipo α) al gruppo OH di residui di Ser o di Thr.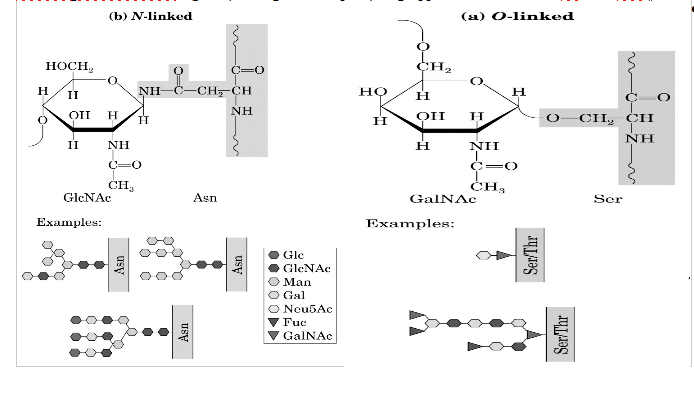
Continua a leggere:
- Successivo: Gli aminoacidi delle proteine
- Precedente: Le pareti cellulari batteriche
Dettagli appunto:
- Autore: Domenico Azarnia Tehran
- Università: Università degli Studi di Roma La Sapienza
- Facoltà: Scienze Matematiche, Fisiche e Naturali
- Corso: Scienze Biologiche
- Esame: Chimica biologica
- Titolo del libro: Biochimica
- Autore del libro: Donald Voet e Judith G. Voet
- Editore: Zanichelli
- Anno pubblicazione: 1993
Altri appunti correlati:
- Fisiologia della nutrizione
- Biologia molecolare
- Biochimica
- Struttura molecolare delle proteine
- Scienze e tecniche dietetiche applicate
Per approfondire questo argomento, consulta le Tesi:
- Crescita di Chlorella vulgaris in acque reflue da vinificazione: studio della cinetica di crescita e del contenuto in lipidi
- Evidenze nutrizionali per il recupero muscolare nell'atleta di endurance
- The role of CARMA2/CARD14 in NF-kB activation signalling
- Caratterizzazione delle specie ittiche di basso valore commerciale del Golfo di Manfredonia
- Analisi psicologica, biologica e psichiatrica della fenomenologia dell’omicida seriale
Puoi scaricare gratuitamente questo riassunto in versione integrale.


