Analisi dei dati cinetici
A concentrazioni di [S] molto elevate, la velocità iniziale v0 tende ad avvicinarsi in modo asintotico a Vmax. In pratica però, è molto difficile determinare accuratamente la Vmax direttamente dal grafico di v0 in funzione di [S]. Per questo un metodo più corretto per misurare il valore di Vmax e di KM, formulato da Hans Lineweaver e da Dean Burk, utilizza il reciproco dell'equazione di Michaelis-Menten (v0 = Vmax[S]/KM+[S]):
1/v0 = (KM/Vmax) 1/[S] + 1/Vmax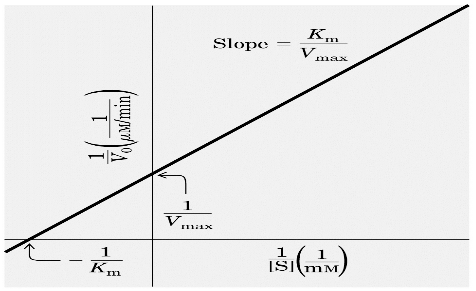
Questa è un equazione lineare rispetto a 1/v0 e 1/[S]. Se queste due entità sono messe in grafico, detto grafico dei doppi reciproci, o di Lineweaver Burk, la pendenza della retta corrisponde a KM/Vmax , l'intercetta sull'asse 1/v0 è 1/Vmax e l'intercetta estrapolata sull'asse 1/[S] rappresenta -1/KM. Uno degli svantaggi di questo grafico è quello di utilizzare concentrazioni di S relativamente alte nella gran parte delle misure sperimentali e quindi i punti tendono ad accumularsi nella parte sinistra del grafico. Per le concentrazioni di S molto basse poi, piccoli errori nella v0 possono generare errori molto più grandi in 1/v0 e quindi nei valori di KM e di Vmax.
L'efficienza catalitica degli enzimi è definita, invece, dalla misura dei suoi parametri catalitici. Posiamo definire così la costante catalitica di un enzima, come:
kcat = Vmax/[E]T
Questa entità è anche conosciuta come il numero di turnover di un enzima, in quanto esprime il numero di volte che ogni sito attivo dell'enzima catalizza la reazione nell'unità di tempo. L'equazione Vmax= k2[E]T ci dice che, per il modello di Michaelis-Menten, kcat corrisponde a k2. Per enzimi con meccanismi più complessi, kcat può dipendere da diverse altre costanti di velocità.
Quando [S]<<KM, si forma molto poco complesso ES. Conseguentemente [E]≈[E]T e quindi l'equazione v0 = (d[P]/dt)t=0 = k2[ES] = k2[E]T[S]/KM+[S] diventa di secondo ordine:
v0 ≈ (k2/KM)[E]T[S] ≈ (kcat/KM)[E][S]
Il rapporto kcat/KM è la costante di secondo ordine apparente della reazione enzimatica; la velocità della reazione varia secondo come l'enzima ed il substrato si incontrano in soluzione. L'entità kcat/KM è quindi una misura dell'efficienza catalitica dell'enzima.
Continua a leggere:
- Successivo: Inibizione enzimatica
- Precedente: Cinetica enzimatica
Dettagli appunto:
- Autore: Domenico Azarnia Tehran
- Università: Università degli Studi di Roma La Sapienza
- Facoltà: Scienze Matematiche, Fisiche e Naturali
- Corso: Scienze Biologiche
- Esame: Chimica biologica
- Titolo del libro: Biochimica
- Autore del libro: Donald Voet e Judith G. Voet
- Editore: Zanichelli
- Anno pubblicazione: 1993
Altri appunti correlati:
- Fisiologia della nutrizione
- Biologia molecolare
- Biochimica
- Struttura molecolare delle proteine
- Scienze e tecniche dietetiche applicate
Per approfondire questo argomento, consulta le Tesi:
- Crescita di Chlorella vulgaris in acque reflue da vinificazione: studio della cinetica di crescita e del contenuto in lipidi
- Evidenze nutrizionali per il recupero muscolare nell'atleta di endurance
- The role of CARMA2/CARD14 in NF-kB activation signalling
- Caratterizzazione delle specie ittiche di basso valore commerciale del Golfo di Manfredonia
- Analisi psicologica, biologica e psichiatrica della fenomenologia dell’omicida seriale
Puoi scaricare gratuitamente questo riassunto in versione integrale.


