Regolazione dell'attività enzimatica
Un organismo deve essere capace di regolare l'attività catalitica degli enzimi che contiene in modo da poter coordinare i suoi numerosi processi metabolici, rispondere a variazioni nell'ambiente che lo circonda, crescere e differenziare, tutto in maniera ordinata. Ciò può avvenire in due modi:
1.Controllo della disponibilità dell'enzima: la quantità di un dato enzima nella cellula dipende sia dalla sua velocità di sintesi, sia dalla sua velocità di degradazione. Queste due velocità sono direttamente controllate dalla cellula. Per esempio, l'E.coli, quando cresce in assenza del disaccaride lattosio, perde l'enzima che metabolizza questo zucchero. Appena pochi minuti dopo aver aggiunto il lattosio, questi batteri cominciano a sintetizzare l'enzima necessario per utilizzare questa sostanza come nutriente;
2.Controllo dell'attività enzimatica: l'attività catalitica di un enzima può essere regolata mediante alterazioni conformazionali o strutturali;
In quest'ultimo tipo di controllo, possiamo vedere come l'attività di alcuni enzimi viene regolata mediante modificazioni covalenti reversibili, di solito fosforilazioni di un residuo di serina , come nell'aspartato transcarbamilasi (ATCasi). Quest'ultimo catalizza la formazione di N-carbamilaspartato a partire da carbamil fosfato e aspartato: 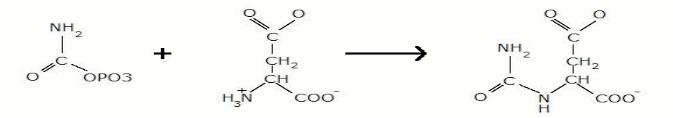
Questa reazione è la prima tappa per la biosintesi delle pirimidine, uno dei componenti principali degli acidi nucleici. Questo enzima, comunque, presenta un comportamento allosterico in quanto troviamo un legame omotropico di tipo cooperativo positivo per entrambi i suoi substrati, aspartato e carbamil fosfato. Inoltre, L'ATCasi viene inibita eterotropicamente dalla citidina trifosfato (CTP), un nucleotide pirimidinico, e viene sempre eterotropicamente attivato dall'adenosina trifosfato (ATP), un nucleotide purinico. Il CTP quindi fa diminuire la velocità enzimatica, mentre l'ATP la fa aumentare. IL CTP è un precursore degli acidi nucleici, di conseguenza, quando una rapida biosintesi degli acidi nucleici ha deprivato la cellula di CTP, questo effettore si dissocia dall'ATCasi per azione di massa, rimuovendo l'inibizione dell'enzima e aumentano la velocità di sintesi di CTP. A contrario, se la velocità di sintesi si CTP supera quella della sua utilizzazione, l'eccesso di CTP che si genera andrà ad inibire l'ATCasi con il risultato di ridurre la sintesi dello stesso CTP. Questo è un esempio di inibizione a feedback (retroinibizione), un sistema di regolazione metabolica molto comune, in cui la concentrazione del prodotto della via biosintetica controlla l'attività di un enzima posto all'inizio di quella via.
Il significato metabolico dell'attivazione dell'attivazione dell'ATCasi da parte dell'ATP è pure molto importante in quanto tende a coordinare tra loro le velocità di sintesi dei nucleotidi purinici e piramidinici, che sono richiesti in quantità abbastanza simili nella sintesi degli acidi nucleici.
L'ATCasi in E.coli ha una composizione in subunità del tipo c6r6, dove c ed r rappresentano rispettivamente le subunità catalitiche e regolatrici. Le subunità catalitiche sono organizzate in trimeri (c3) in contatto con le subunità regolatrici organizzate in tre dimeri regolatori (r2) per formare una molecola con una simmetria rotazionale, simile ad un prisma triangolare (simmetria D3). Ogni dimero regolatore unisce due subunità catalitiche presenti in trimeri c3 diversi. I trimeri catalitici dissociati mantengono l'attività enzimatica, mentre i dimeri regolatori isolati legano questi effettori allosterici, ma sono privi di attività catalitica. Evidentemente, le subunità regolatrici modulano allostericamente nell'enzima intatto l'attività delle subunità catalitiche. Come predetto dalla teoria dell'allosterismo, l'attivatore ATP si lega preferenzialmente all'ATCasi attiva (stato R o forma ad alta affinità per il substrato), mentre l'inibitore CTP si lega alla forma inattiva dell'enzima (stato T o a bassa affinità per il substrato. L'analogo bisubstrato non reattivo N-(fosfonacetil)-L-aspartato (PALA) si lega saldamente all'ATCasi nello stato R, ma non nello stato T (l'uso di analoghi non reattivi del substrato è piuttosto comune nello studio dei meccanismi di azione degli enzimi, in quanto formano complessi stabili facilmente manipolabili). La regione della proteina che va incontro alla modificazione conformazionale più pronunciata durante la transizione T→R è un cappio (loop) flessibile nella subunità catalitica (c) il cosiddetto 240s loop. Questo riorientamento del loop potrebbe essere la causa della modificazione nella struttura quaternaria che si ha durante la transizione verso lo stato R. Dal confronto delle due strutture, T ed R, si è osservato inoltre che i trimeri catalitici dell'enzima si separano lungo l'asse della molecola e si riorientano con una rotazione intorno all'asse di circa 10°; i dimeri regolatori, invece, ruotano di 15° intorno al loro asse e si allontanano. Questa profonda modificazione della struttura quaternaria ricorda ciò che accade nel passaggio da deossiemoglobina a ossiemoglobina. Inoltre come in quest'ultimo caso, il legame del substrato ad una subunità catalitica aumenta l'affinità di legame del substrato e l'attività catalitica delle altre subunità mediante un processo di cooperatività positiva. Bassi livelli di PALA attivano quindi l'ATCasi, promuovendo la transizione T→R: l'ATCasi ha una così elevata affinità per questo analogo bisubstrato non reattivo che il legame di una sola molecola di PALA converte tutte e sei le subunità catalitiche nello stato R. L'ATCasi segue molto da vicino il modello simmetrico dell'allosterismo. Gli studi ai raggi X hanno anche indicato che il CTP e l'ATP si legano alla stessa regione della subunità regolatrice e così questi effettori devono almeno in parte condividere il sito di legame, anche se essi hanno effetti opposti sull'attività catalitica della ATCasi.
Continua a leggere:
- Successivo: Nomenclatura degli enzimi
- Precedente: I coenzimi: definizione
Dettagli appunto:
- Autore: Domenico Azarnia Tehran
- Università: Università degli Studi di Roma La Sapienza
- Facoltà: Scienze Matematiche, Fisiche e Naturali
- Corso: Scienze Biologiche
- Esame: Chimica biologica
- Titolo del libro: Biochimica
- Autore del libro: Donald Voet e Judith G. Voet
- Editore: Zanichelli
- Anno pubblicazione: 1993
Altri appunti correlati:
- Fisiologia della nutrizione
- Biologia molecolare
- Biochimica
- Struttura molecolare delle proteine
- Scienze e tecniche dietetiche applicate
Per approfondire questo argomento, consulta le Tesi:
- Crescita di Chlorella vulgaris in acque reflue da vinificazione: studio della cinetica di crescita e del contenuto in lipidi
- Evidenze nutrizionali per il recupero muscolare nell'atleta di endurance
- The role of CARMA2/CARD14 in NF-kB activation signalling
- Caratterizzazione delle specie ittiche di basso valore commerciale del Golfo di Manfredonia
- Analisi psicologica, biologica e psichiatrica della fenomenologia dell’omicida seriale
Puoi scaricare gratuitamente questo riassunto in versione integrale.


