Fosfopantoteina e coenzima A
Sono derivati della vitamina B3.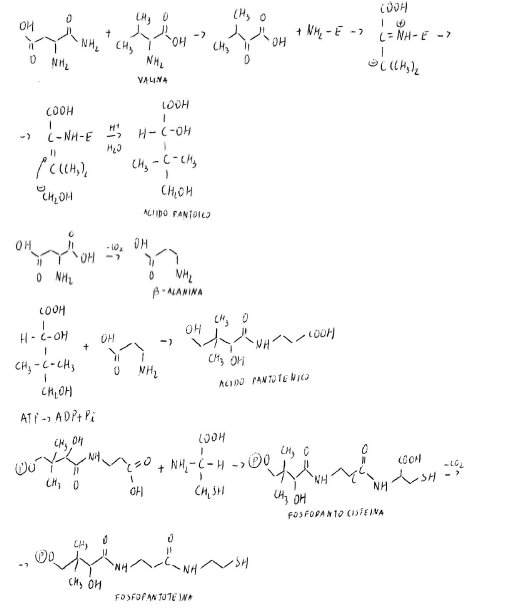
La fosfopantoteina ha un braccio spaziatore con residui apolari e polari in gradi di adattarsi al sito catalitico della proteina. SH è un buon gruppo per molecole acide: quindi è un trasportatore di acili.
ATP + P-PANTOTEINA → PPi + DEFOSFO-CoASH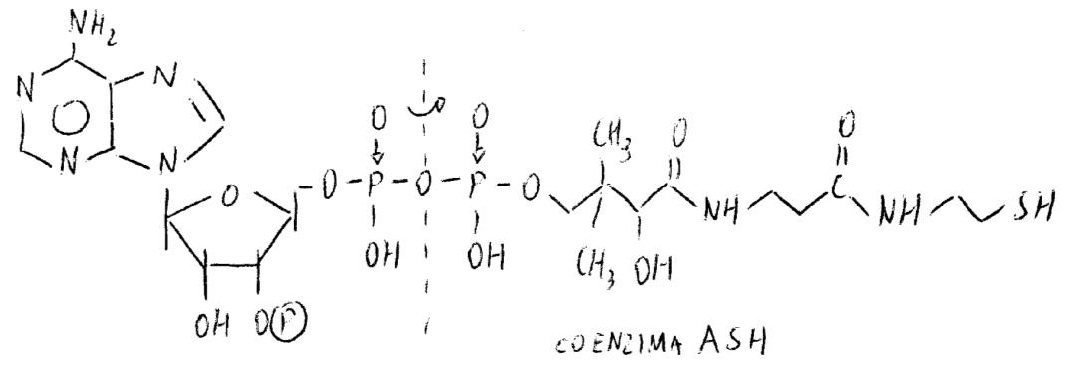
Il terminale si forma dietro l’adenina tra cui s’inserisce il metallo cofattore, che ha 2 interazioni con l’adenina (con 1N e N sostituente in 6) e 2 con il braccio (con l’ultimo N della sequenza e con S).
Le transizioni fanno abbassare la pk2 di dissociazione di SH da un valore di circa 11 a un valore di circa 7 (pH fisiologico). Il solfoidrile può così accettare acili.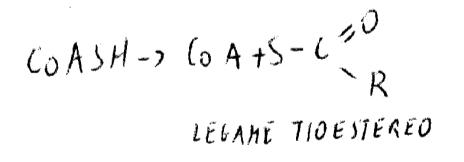
CoA viene riconosciuto dalla apoproteina per la presenza del fosforile in 3’ (sito di riconoscimento e aggancio alla apoproteina con legame ionico) e per l’organizzazione molecolare dell’acile: il livello di insaturazioni o l’OH sono motivi di cambiamento della costante di dissociazione tra l’apoproteina e il coenzima perché ci sono stretti contatti tra l’acile e il residuo amminoacidico della proteina; il cambiamento conformazionale modifica i contatti, cambia la costante e il substrato abbandona l’apoproteina.
Continua a leggere:
- Successivo: Coenzima derivato dalla vitamina B6
- Precedente: Transferasi
Dettagli appunto:
-
Autore:
Marco Lazzara
[Visita la sua tesi: "Determinazione di arsenico mediante voltammetria di stripping anodico con elettrodo in oro"]
[Visita la sua tesi: "I laser a coloranti: fondamenti e stato dell'arte"]
- Università: Università degli Studi di Torino
- Facoltà: Scienze Matematiche, Fisiche e Naturali
- Corso: Chimica
- Esame: Biochimica
- Docente: Carlo Giunta
Altri appunti correlati:
- Biochimica
- Fondamenti di chimica
- Appunti di Biochimica
- Catecolamine e glucagone
- Chimica Analitica Strumentale (Spettroscopia)
Per approfondire questo argomento, consulta le Tesi:
- Analisi dei nitriti attraverso il loro impiego nell’industria alimentare e applicazione di un’indagine percettiva sui consumatori
- Meccanismi biochimici ed effetti sulla salute umana del licopene
- Studio dei processi di degrado su manufatti archeologici in ambiente marino sommerso e sperimentazione di procedure innovative per la conservazione in situ
- Bio-lubricant from the olive mill waste through a new biocatalyst immobilized on ZnFe2O4
- Rational Design and Synthesis of Novel Acadesine-Like Modulators of AMPK
Puoi scaricare gratuitamente questo appunto in versione integrale.


