Interazioni col sito attivo
FMN, più piccolo del FAD, occupa uno spazio localizzato in una tasca dell’apoproteina dove è inserito come metallo prostetico Fe in grado di dare 4 dei suoi legami verso il coenzima (verso 1N, O sostituente in 2, O sostituente in 4 e 5N). Queste interazioni promuovendo equilibri tautomerici, mettono il coenzima in grado di accettare/cedere unità riducenti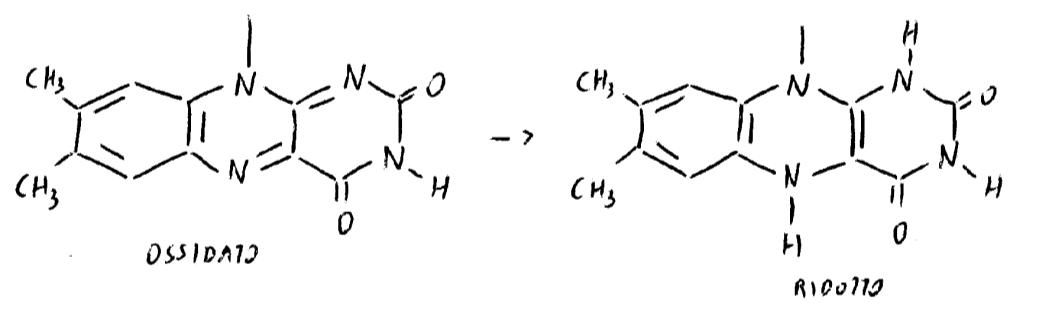
Interposizione di un metallo cofattore con 4 coordinazioni tra le due basi: per l’adenina con 1N e N sostituente in 6, per la flavina con O sostituente in 4 e 5N.
INTERAZIONI CON COENZIMI PIRIDINICI
È in funzione delle posizione che occupano nella serie elettrochimica dei componenti biologici.![]()
IN NATURA L’EQUILIBRIO È SPOSTATO VERSO SINISTRA
Si forma ∙OH per trasformazione del substrato legato nel sito catalitico, che acquisisce 2 ∙OH per mole di O2.
Biorisanamento attraverso monoossigenasi piridinica: trasformazione del fenolo nell’o-difenolo.
Ossigenasi flavinica: demolizione di un legame C-C e apertura dell’anello, si passa da un substrato aromatico a uno alifatico (facilmente biodegradabile).
La proteina a cui si lega il coenzima flavinico in genere può essere un’albumina.
LESIONI BIOCHIMICHE DA CARENZA DI VITAMINA B2
L’alterazione dei cicli metabolici dà un effetto microscopico (alterazione della respirazione cellulare) che porta ad un effetto macroscopico (pellagra).
Le flavoproteine sono coinvolte anche nei processi di biosintesi degli sfingolipidi, i fosfolipidi delle membrane delle cellule nervose. Ciò porta ad un’alterazione nella composizione delle membrane (causa di nevriti).
Continua a leggere:
- Successivo: Coenzimi chinonici
- Precedente: Coenzimi flavinici
Dettagli appunto:
-
Autore:
Marco Lazzara
[Visita la sua tesi: "Determinazione di arsenico mediante voltammetria di stripping anodico con elettrodo in oro"]
[Visita la sua tesi: "I laser a coloranti: fondamenti e stato dell'arte"]
- Università: Università degli Studi di Torino
- Facoltà: Scienze Matematiche, Fisiche e Naturali
- Corso: Chimica
- Esame: Biochimica
- Docente: Carlo Giunta
Altri appunti correlati:
- Biochimica
- Fondamenti di chimica
- Appunti di Biochimica
- Catecolamine e glucagone
- Chimica Analitica Strumentale (Spettroscopia)
Per approfondire questo argomento, consulta le Tesi:
- Analisi dei nitriti attraverso il loro impiego nell’industria alimentare e applicazione di un’indagine percettiva sui consumatori
- Meccanismi biochimici ed effetti sulla salute umana del licopene
- Studio dei processi di degrado su manufatti archeologici in ambiente marino sommerso e sperimentazione di procedure innovative per la conservazione in situ
- Bio-lubricant from the olive mill waste through a new biocatalyst immobilized on ZnFe2O4
- Rational Design and Synthesis of Novel Acadesine-Like Modulators of AMPK
Puoi scaricare gratuitamente questo appunto in versione integrale.


