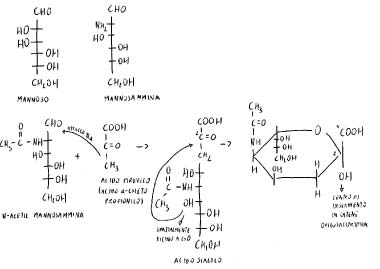
Condensazione semiacetalica.
L’acido sialico può venire usato come componente di strutture superiori, e nel trasferimento nell’oligosaccaride gli vengono trasferite le sue proprietà acide.
La catena può essere semplice o ramificata.
Struttura rigida con proprietà di identificazione verso molecole che possono complementarsi con essa.
Il residuo in 1 è l’estremo riducente, quello in n è quello non riducente.
Le ramificazioni possono essere con legame 1-6,1-4 o 1-3 β-glicosidico (massima stabilità, massima durata della semivita).
OLIGOSACCARIDE + PROTEINA → MUCOIDE
Non è un legame salino (facilmente scindibile con variazioni di I, pH), ma avviene in un punto specifico della sequenza peptidica (sequenza con senso di inserimento monosaccaridico); da quel punto c’è un amminoacido in cui può essere inserito l’oligosaccaride con la formazione di un legame covalente.
AMMINOACIDI CHE ACCETTANO LEGAME GLUCOSIDICO
• S, T (-OH): aa-O-β-GALATTOSO-OLIGOSACCARIDE
• N (-CONH2): aa-NH-β-GALATTOSO-OLIGOSACCARIDE
Il residuo oligosaccaridico ha il ruolo di centro di identificazione nel caso di proteine legate a sistemi informativi (ad esempio l’ormone tireotropo dell’ipofisi che stimola la tiroide è un mucoide il cui oligosaccaride viene riconosciuto dai ricettori delle cellule della tiroide); in altri si occupa di aumentare la solubilità della proteina: le caseine restano in soluzione per la presenza di numerosi residui oligosaccaridici che ne consentono una buona solubilità, l’enzima taglia l’oligosaccaride, la caseina perde la solubilità e precipita come aggregato. Il fibrinogeno del sangue, quando l’enzima trombina taglia la frazione peptidica con l’oligosaccaride, diventa fibrina e il sangue coagula.
Protoglicani: semplici aggregati più o meno ordinati di oligosaccaridi e proteine.
Mucoprotidi: rapporto eteropolisaccaride-proteina di tipo salino.
Mucoidi: oligosaccaridi legati in posizione specifica nel peptide, che possono essere identiche o diversificate, coinvolte in sistemi di riconoscimento (ad esempio IG).