Specificità di substrato enzimatico
Specificità di substrato enzimatico
In generale, un sito di legame per il substrato è costituito da un incavo (o da una fessura) sulla superficie della molecola enzimatica che ha una forma complementare a quella del substrato (complementarietà geometrica). Inoltre, i residui amminoacidici che formano il sito di legame sono organizzati in modo da interagire con il substrato mediante attrazioni elettrostatiche (complementarietà elettronica). Le molecole che differiscono dal substrato per la forma o per la distribuzione di gruppi funzionali non si possono legare produttivamente all'enzima; quindi, questi composti non possono generare complessi enzima-substrato, che determinano poi la formazione di qualsiasi prodotto.STEROSPECIFICITA'
Gli enzimi sono altamente specifici sia nel legame di substrati chiralici, sia nel catalizzare le loro reazioni. Questa stereospecificità deriva dal fatto che gli enzimi, possedendo essi stessi una specifica chiralità (le proteine sono costituite solo da L-amminoacidi), formano siti attivi asimmetrici. Per esempio, la tripsina idrolizza rapidamente polipeptidi composti dal L-amminoacidi, ma non quelli contenenti D-amminoacidi. La prima prova che gli enzimi sono assolutamente stereospecifici nella reazione che catalizzano, è stata quella dell'alcol deidrogenasi del lievito (YADH). L'alcol deidrogenasi catalizza l'interconversione dell'etanolo in acetaldeide e viceversa, secondo la reazione:
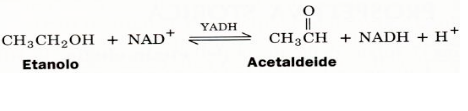
L'etanolo come possiamo osservare è una molecola prochiralica:
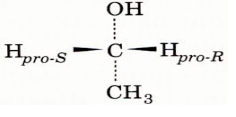
Se uno dei due atomi di idrogeno venisse convertito in un altro
atomo o gruppo funzionale (diverso da CH3 o da OH), l'atomo
C(1) diventerebbe un centro chiralico. Per questo i due atomi
di H vengono detti prochiralici. Il legame specifico di un centro
prochiralico ad un sito di legame sull'enzima permette all'enzima
stesso di distinguere tra gruppi prochiralici diversi. É stata identificata la natura stereospecifica della reazione della YADH mediante una serie di esperimenti condotti da Westheimer e Vennesland:
1.Se nella reazione dello YADH viene utilizzato etanolo denaturato, il prodotto NADH è denaturato (NADD);
2.Se questo NADD viene isolato e utilizzato nella reazione inversa per ridurre acetaldeide normale non marcata, il deuterio viene trasferito quantitativamente dal NADD al prodotto etanolo;
3.Se viene prodotto nel modo seguente l'enantiomero del CH3CHDOH formato in precedenza, nessun atomo di deuterio può essere trasferito dall'etanolo al NAD+ nella reazione inversa.
(1) (2)
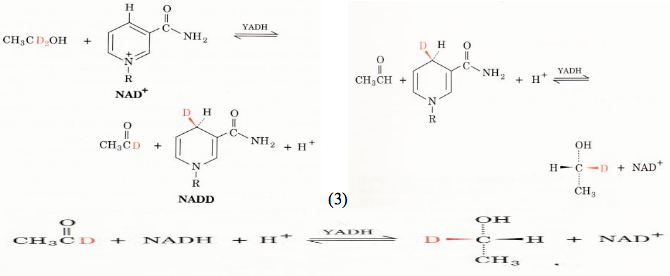
Dunque, nella razione dello YADH, vi è un trasferimento diretto di un atomo di idrogeno (Esperimenti 1 e 2) e l'enzima YADH è in grado di distinguere tra gli atomi di idrogeno pro-S e pro-R dell'etanolo. In seguito è stato dimostrato, che la YADH trasferisce l'atomo di idrogeno pro-R dell'etanolo alla faccia re dell'anello nicotinamidico del NAD+.
SPECIFICITA' GEOMETRICA
Oltre alla loro specificità, la maggior parte degli enzimi è selettiva anche per l'identità dei gruppi chimici presenti sul substrato (specificità geometrica). La maggior parte degli enzimi catalizza le reazioni di un piccolo numero di composti tra loro simili, altri, invece, sono assolutamente specifici per un solo composto con determinate e dettagliate caratteristiche.
Continua a leggere:
- Successivo: I coenzimi: definizione
- Precedente: Gli enzimi: prospettiva storica
Dettagli appunto:
- Autore: Domenico Azarnia Tehran
- Università: Università degli Studi di Roma La Sapienza
- Facoltà: Scienze Matematiche, Fisiche e Naturali
- Corso: Scienze Biologiche
- Esame: Chimica biologica
- Titolo del libro: Biochimica
- Autore del libro: Donald Voet e Judith G. Voet
- Editore: Zanichelli
- Anno pubblicazione: 1993
Altri appunti correlati:
- Fisiologia della nutrizione
- Biologia molecolare
- Biochimica
- Struttura molecolare delle proteine
- Scienze e tecniche dietetiche applicate
Per approfondire questo argomento, consulta le Tesi:
- Crescita di Chlorella vulgaris in acque reflue da vinificazione: studio della cinetica di crescita e del contenuto in lipidi
- Evidenze nutrizionali per il recupero muscolare nell'atleta di endurance
- The role of CARMA2/CARD14 in NF-kB activation signalling
- Caratterizzazione delle specie ittiche di basso valore commerciale del Golfo di Manfredonia
- Analisi psicologica, biologica e psichiatrica della fenomenologia dell’omicida seriale
Puoi scaricare gratuitamente questo riassunto in versione integrale.


