Struttura delle proteine
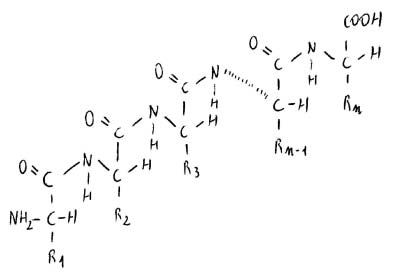
Polimero peptidico vettoriale: i due amminoacidi terminali non sono equivalenti (αC ha NH2, αCn ha NH; 1C1 ha NH, 1Cn ha OH).
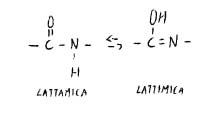
Nel caso di un peptide l’equilibrio è spostato verso destra (confermato da misure di lunghezza di legame): corrisponde ad un doppio legame; ciò vuol dire che si ha una certa rigidità e che si ha stereoisomeria geometrica.
È positivo alla reazione del biureto.
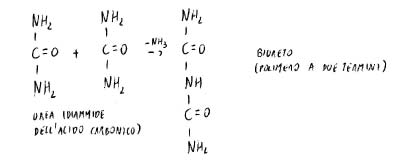
N-H blocca la possibile risonanza del legame del biureto. Aumenta quindi esponenzialmente la frequenza di risonanza del doppio legame sulle posizioni terminali (opposizione alla risonanza).
In soluzione l’equilibrio è spostato verso il biureto; in presenza di Cu2+ si forma un complesso.
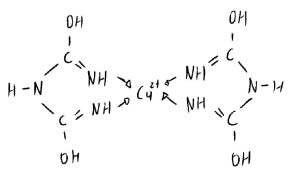
Il peptide presenta forma lattimica e può complessare Cu2+ (reazione qualitativa e quantitativa).
Analisi sequenziale
In condizioni anidre.
Si utilizza il feniltioisocianato che reagisce con l’azoto di αC, quindi in un peptide reagisce solo quello in posizione 1.
Continua a leggere:
- Successivo: Degradazione di Edman
- Precedente: PROTEINE
Puoi scaricare gratuitamente questo appunto in versione integrale.


