Il secondo virus trasmesso per via respiratoria di cui parleremo oggi è il RINOVIRUS, virus responsabile del raffreddore.
Questa è un infezione virale estremamente diffusa, il 50% dei raffreddori sono causati da questo virus, è una malattia paragonata ad un influenza piuttosto benigna che si risolve grazie all'intervento di una forte e pronta risposta del sistema immunitario innato, nell’arco di pochi giorni.
Il Rinovirus appartiene ai PicoRnavirus: Pico sta ad indicarne le ridotte dimensioni di questi virus, RNA in quanto questa molecola costituisce il genoma dei Picornavirus.
Caratteristiche del rhinovirus
Hanno un diametri di circa 25-30 nm, assenza di un involucro pericapsidico, il capside è icosaedrico e racchiude una singola molecola di RNA, caratterizzata dall’avere una polarità positiva. A polarità positiva vuol dire che è un
genoma infettante, se in laboratorio riesco ad eliminare tutta la porzione proteica di una particella virale e far penetrare nella cellula suscettibile esclusivamente il genoma, quel genoma e lui solo è in grado di instaurare un ciclo replicativo, in quanto proprio per la sua polarità positiva può prendere immediatamente contatto con i ribosomi ed essere tradotto in una proteina. Quindi, stiamo esaminando una classe di virus in cui la prima sintesi macromolecolare dopo che una cellula è stata infettata è rappresentata da un processo di sintesi proteica.
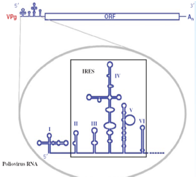
Caratteristica di questi virus all'estremità 5' (molto schematicamente in questo disegno è indicato con un trattino rosso) sono privi di cap e invece in posizione 5' troviamo legato una proteina VPg formata da circa una ventina di amminoacidi. All'estremità 3' è invece presente una coda di poli-A.
Con l'eccezione del pro-virus di cui parleremo tra poco, sono virus che resistono in un range piuttosto alto di ph che va da 3 a 9. Altra caratteristica che gli differenzia dal virus dell'influenza, che abbiamo esaminato la scorsa volta, abbiamo detto che il virus influenzale ha la necessità di raggiungere il nucleo, perché la sua RNA polimerasi RNA dipendente ha la necessità di un innesco e se lo procura tagliando il cap, la subunità Pb1 della polimerasi dell'influenza taglia il cap dei messaggeri cellulari e lo utilizza per compiere il proprio processo di trascrizione ed arrivare così alla sintesi dei messaggeri(9.20) del virus dell'influenza.
Vediamo come i Picornavirus hanno scelto una strada completamente diversa, il loro RNA messaggero è sprovvisto di un cap ed è questo uno degli stratagemmi che consente ai Picornavirus di prendere il sopravento sugli RNA messaggeri che si trovano nel citoplasma di quella cellula. La replicazione di questo virus è esclusivamente citoplasmatica in cellule enucleate è stato dimostrato che si può realizzare la replicazione di questi virus.
Appartengono ai Picornavirus diversi generi:
• abbiamo il genere degli Enterovirus che comprende il Poliovirus e il Coxsackie. La Poliomielite di cui parleremo più avanti in questa lezione, è una grave malattia che induce l'insorgenza di una paralisi flaccida, colpisce i muscoli respiratori, come pure il muscolo cardiaco ed è una malattia mortale, è un’infezione in via di eradicazione, l'organizzazione mondiale della sanità grazie alla disponibilità di vari vaccini può arrivare a far scomparire questo virus dalla faccia della Terra.
Secondo voi può essere possibile realizzare un piano di questo tipo per l'influenza? No, sapete sicuramente che un virus che è stato eradicato proprio in quest'ultima capillare vaccinazione è stato il virus del vaiolo l'ultimo caso è avvenuto in Somalia alla fine degli anni '70.
Da cosa dipende? Sicuramente dalla natura del virus.
Perché possiamo pensare di eradicare il Poliovirus e non il virus dell'Influenza o il virus della Rabbia? Il Poliovirus infetta esclusivamente l'uomo e la stessa situazione l'abbiamo nel vaiolo, quindi, in una vaccinazione capillare in tutto il mondo tutti gli individui coperti grazie al vaccino, quindi il virus non ha più ospite e possiamo dichiaralo debellato.
Pensate un attimo a quella diapositiva che abbiamo osservato una settimana fa... quali erano gli ospiti del virus dell'influenza? Uomini, uccelli, maiali, tanti altri mammiferi.. quindi è chiaro che è impensabile pensare di controllare una simile situazione con un processo di vaccinazione.
Oggi in Europa è considerata debellata, proprio non esiste più questa infezione, però c'è sempre la possibilità che persone che arrivano da altri Paesi possano veicolare il virus in Italia ed è per questo la vaccinazione è ancora obbligatoria.
• il secondo genere dei Picornavirus sono i Rhinovirus.
• fa sempre parte dei Picornavirus il genere
Hepatovirus che comprende il virus dell'epatite A, che differentemente dall'epatite B e C da infezioni acute, infezioni che non cronicizzano.
• abbiamo poi il
Cardiovirus responsabile di infezioni a livello cardiaco ed encefalico,
• e infine appartenente al genere
Apthovirus il virus dell'afta epizootica patogeno soprattutto per i bestiami e crea non pochi problemi economici.
Schematicamente come al solito iniziamo con una diapositiva molto semplice che indica quali sono i momenti salienti del ciclo replicativo dei Rinovirus.
Il ciclo replicativo dei Rinovirus
È un virus nudo che ha differenza del virus dell'influenza
non ha un peplos, quindi i costituenti chimici di questo virus saranno: le proteine del capside icosaedrico e il genoma costituito da RNA.
Avviene l'adsorbimento, il virus riconosce negli epiteli del naso i recettori al quale si può legare e contrariamente da quanto è indicato in questa figura entra attraverso un processo di endocitosi. Al processo di endocitosi segue l'uncoating e si ha liberazione del RNA virale. Questo RNA è a polarità positiva e può prendere direttamente il contatto con i ribosomi e potrà quindi essere tradotto nelle proteine virali. Tra queste proteine un ruolo fondamentale è svolto dal RNA polimerasi RNA dipendente.
Vi ricordate il virus dell'influenza che ha polarità negativa?
Non può quindi essere immediatamente tradotto ed è costretto a portarsi dietro l'RNA polimerasi RNA dipendente. Tutti gli RNA virus devono avere a disposizione quest'attività enzimatica.
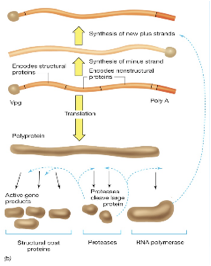
Cosa fa il Rinovirus?
Può essere immediatamente tradotto e una delle proteine così prodotte è un RNA polimerasi RNA dipendente. Copierà il genoma a polarità positiva e formerà l'antigenoma, ossia catene di RNA a polarità negativa che a loro volta saranno stampo per la formazione di nuove catene a polarità + e quindi da una parte abbiamo avuto la sintesi delle proteine strutturali, secondo questa strada siamo arrivati alla sintesi di nuovi genomi, quindi, nuovi genomi e particelle strutturali si possono combinare insieme per formare una nuova progenie virale che poi viene liberata dalla cellula infetta. Quindi, uno schema sicuramente più semplice rispetto a quello che abbiamo esaminato studiando l'influenza. Per quanto riguarda la struttura dei Picornavirus abbiamo capsidi icosaedrici, quasi sferici e concorrono alla formazione 4 proteine virali. Queste quattro proteine sono indicate con VP1, VP2, VP3 e VP4. Ciascuna di queste 4 proteine è presente 60 volte nel capside icosaedrico finale, queste quattro proteine si assemblano tra di loro a formare delle sub-unità, ogni sub-unità è formata da VP1, VP2, VP3 e VP4. E poi si arrangiano queste sub-unità a formare un profilo pentamerico alla quale diamo il nome di pentamero. Cinque proteine VP1concorrono a formare il vertice dell'icosaedro. Nell'icosaedro le proteine VP1, VP2 e VP3 sono esposte alla superficie del capside, mentre la proteina VP4 ha localizzazione più interna.
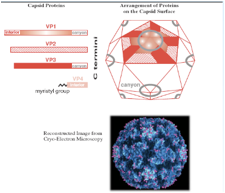
Una caratteristica di alcuni Picornavirus e tra questi i Rinovirus e il Poliovirus è quello di avere intorno ai vertici dell'icosaedro (cerchietto grigio) delle depressioni a queste depressioni è dato il nome di canyon ed è nel pavimento di questi canyon che si trova localizzato l’anti-recettore responsabile dell'attacco del virus alla cellula ospite. Nella maggior parte dei casi gli anti-recettori virali protrudono verso l'esterno per incontrare facilmente il recettore presente nella cellula ospite, qui abbiamo una situazione inversa. Il capside proteico presenta questi canyon ed è nel fondo di questi canyon che è localizzato il recettore che lega I-CAM che è il recettore presente nelle cellule al quale il Rinovirus si può legare. Analogamente oltre che legare il recettore al fondo del canyon e dare quindi inizio ad un ciclo replicativo del Rinovirus, il canyon può anche essere occupato da anticorpi e di conseguenza in questo caso verrà bloccato l'adsorbimento del virus alla cellula ospite, quindi in questo caso grazie alla presenza di specifici anticorpi che bloccano il sito di ingresso dei Rinovirus, il Rinovirus si dice che è neutralizzato.
Chi è questo recettore I-CAM riconosciuto dal Rinovirus?
Si trova diffuso negli epiteli del naso, come pure negli epiteli bronchiali e dei polmoni ed ha il ruolo fisiologico nella superficie dei linfociti di partecipare alla risposta immunitaria. È un membro della super famiglia delle immunoglobuline ossia una famiglia di proteine che ha caratteristiche strutturali che ricordano quelle delle immunoglobuline.
E cosa succede una volta che I-CAM si combina con l'anti-recettore presente nel Rinovirus?
La cellula espone I-CAM si può pertanto legare alla particella di Rinovirus ed ecco che si ha un cambio conformazionale che consente alla particella virale di penetrare nel citoplasma della cellula infetta in un processo di endocitosi. Ancora una volta come abbiamo visto per il virus dell'influenza pompe protoniche presenti nella superficie dell'endosoma fanno sì che all'interno si abbia un crollo del Ph, il meccanismo per quanto riguarda il Rinovirus non è molto noto si pensa ad un cambio conformazionale che realizza l'uncoating con liberazione del RNA virale che come vi ho detto più volte è a polarità positiva.
Diversa è la modalità di ingresso realizzata da un altro Picornavirus che è il Poliovirus. Il Polio riesce a far penetrare il proprio genoma all'interno della cellula ospite mantenendo il capside all’esterno della cellula. L'anti-recettore riconosciuto dal Poliovirus è la molecola CD155, il ruolo fisiologico di questa molecola è quello di essere un collante intracellulare, ecco che l'anti recettore è localizzato nel capside del poliovirus nella proteine VP1. Come VP1 prende contatto con il recettore ancora una volta si ha un cambio conformazionale che fa si che la proteina VP4 (proteina capsidica che rimaneva all'interno) salta, ed è a questo punto che l'estremità N-terminale di VP1 protrude verso la membrana citoplasmatica della cellula ospite formando così un canalicolo attraverso il quale può passare il genoma del Polio che raggiunge pertanto il citoplasma.
Ricapitolando: contatto con il recettore cellulare da parte dell'anti-recettore localizzato su VP1, cambio di conformazione con rilascio della proteina VP4 a localizzazione più interna del capside, si ripiegano le estremità N-terminali della VP1 e ripiegandosi verso la membrana citoplasmatica della cellula ospite si forma questo canalicolo attraverso cui può passare l'RNA virale che è un RNA infettante , questo RNA penetra nel citoplasma senza portarsi dietro nessuna proteina in quanto lui da solo è in grado esprimendosi di dare origine all'interno di quella cellula alla formazione di una progenie virale.
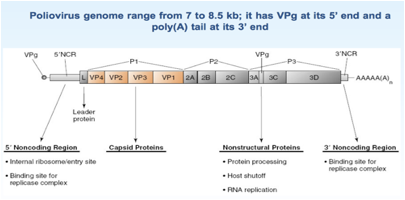
Esaminiamo un po' più nei dettagli come è fatto questo genoma, abbiamo già detto che è un RNA ed è un RNA +.
Andiamo a vedere quanta informazione genetica contiene: nei Picornavirus abbiamo una range che va da 7 a 8.5 kb, abbiamo già sottolineato che è presente all'estremità 5' una proteina VPg e che a questa estremità non è presente un Cap, mentre all'estremità 3' è presente una coda di poliA. I primi geni VP4, VP3, VP2, VP1 contengono l'informazione per la sintesi delle proteine strutturali che sono le proteine che andranno a formare il capside dei Picorna. I geni che seguono invece codificano per proteine non strutturali che intervengono nel corso del ciclo replicativo del Poliovirus. L'informazione di diverse proteine è contenuta in questo RNA, ma siamo in un sistema eucariotico, quindi, il virus si deve essere pensato qualche stratagemma per far si che il proprio messaggero pur tradotto come monocistronico perché solo questo tipo di traduzione è consentita a livello dei ribosomi delle cellule eucariotiche è un stratagemma per riuscire pur essendo tradotto come RNA monocistronico ad arrivare alla sintesi di tutte le proteine che li servono per completare il proprio ciclo replicativo.
Come aveva risolto questo problema il virus dell'influenza? Ha il genoma diviso a pezzi e ogni pezzo sintetizza per un messaggero e fa anche splicing per aumentare il numero delle proteine a propria disposizione.
Diverso e probabilmente più antico come soluzione è quella scelta dai Picornavirus, questo RNA viene tradotto in unico polipeptide, proteasi virali lo tagliano in tanti pezzi in maniera che il virus riesce ad avere a sua disposizione sia le proteine strutturali del capside, sia proteine ad attività enzimatica tra queste è fondamentale la proteina codificata dal gene 3D che sintetizzerà l'RNA polimerasi RNA dipendente.
Non vi ho detto una cosa importante: all'estremità 5' esiste una prima sequenza che non viene tradotta è una regione 5' non codificante che svolge un ruolo determinante perché questo RNA messaggero privo di cap possa essere tradotto.
Come è caratterizzata questa sequenza 5' non codificante? Nel Polio e nel Rino come anche in altri Picornavirus anche se con diversa conformazione questa porzione 5' non codificante è caratterizzata da una struttura secondaria che porta alla formazione di ben 6 ripiegamenti a forcina, questo tratto viene indicato con l'acronico IRES che vuol dire: sito di riconoscimento interno ai ribosomi.
È grazie al riconoscimento di questa struttura secondaria in prossimità del terminale 5' che l'RNA messaggero dei Picorna riesce a prendere contatto con i ribosomi. Volvo a questo punto aprire una piccola parentesi perché proprio il sequenziamento di questa porzione iniziale del genoma dei Picorna ha consentito di avere informazioni per un vaccino impiegato per il controllo della Poliomielite.
Il vaccino per la poliomielite
Voi sapete che a metà dagli anni ‘50 in Europa e negli Stati Uniti (parti del mondo più evolute economicamente e che avevano raggiunto un buono standard di condizioni igieniche) scoppia un epidemia di Poliomielite con un numero di casi estremamente elevati. Lo stesso presidente degli Stati Uniti fu colpito dalla Poliomielite e diede la spinta per la ricerca di nuove soluzioni, contribuendo con grossi finanziamenti.
Però la domanda da farsi è questa: “perché ad un certo punto negli anni precedenti all'inizio del ‘900 la poliomielite è presente in tutto il mondo sotto forma endemica?”.
Arriviamo a metà del ‘900 e scoppiano queste epidemie e scoppiano in Stati Uniti, Europa quindi regioni socialmente ed economicamente più progredite, questo è stato determinato proprio dal comportamento dell'uomo: il poliovirus è trasmesso nel circuito oro-fecale.
Che situazione c'era agli inizi del ‘900? Standard igienico-sanitari estremamente bassi in tutto il mondo, ed ecco che è estremamente facile e probabile che un neonato, acquisiste nel primo periodo della sua vita l'infezione poliomielitica che si accompagnava con il fatto che questo neonato aveva ancora anticorpi anti-polio che passivamente aveva ricevuto dalla madre. Il bambino così non si ammala e mette in motto anche una propria risposta immunitaria.
Cosa succede in Stati Uniti e America con il passare degli anni? Aumenta il benessere, aumentano le condizioni igieniche, i bambini sono ben curati e ben lavati e questo determina che il neonato non incontri nei primi mesi della sua vita il poliovirus ma il primo incontro è rimandato all'adolescenza. Il bambino non avrà più anticorpi trasmessi passivamente dalla madre, per motivi ancora non molto chiari il contatto nell'adolescenza il poliovirus è molto più virulento e questo ha scatenato l'epidemia che si è verificata intorno alla metà del ‘900.
Negli Stati Uniti sono stati dati moltissimi finanziamenti alla ricerca di un vaccino e la scienza ha risposto prontamente, tanto che sono stati allestiti due tipi di vaccini entrambi con ottimi risultati per il controllo del Poliovirus. Il primo vaccino realizzato è quello prodotto da Salk e successivamente un vaccino venne allestito da Sabin. Sono due principi vaccinanti estremamente differenti.
Chi è che mi dice cos'è un vaccino? Abbiamo un virus, noi vogliamo arrivare ad utilizzare questo virus per stimolare il sistema immunocompetente. Nei metodi tradizionali di vaccinazione dobbiamo prendere questo virus far si che mantenga la sua struttura antigenica, ossia che sia in grado di stimolare il sistema immunitario ma che ovviamente abbia perso la sua virulenza.
Il vaccino anti-polio di Salk è un virus inattivato, cosa vuol dire? È un virus morto, il poliovirus viene trattato con formolo, ovviamente se il virus è morto perde la capacità di replicare e quindi perde la propria virulenza, mantiene però la sua struttura antigenica. Il vaccino di Sabin è un virus attenuato, è un virus vivo che mantiene la sua struttura antigenica però continua a replicarsi, lo possiamo impiegare come vaccino in quanto è un virus inattivato che ha perso la virulenza.
Vi ho detto un minuto fa che il Poliovirus si trasmette nel circuito oro-fecale. Quindi cibo contaminato da feci, acqua fognaria che viene usata per irrigare un campo di insalata, uno si mangia l'insalata e insieme all'insalata si mangia anche il poliovirus, penetra e replica nell'oro-faringe ma anche nell'intestino, c'è una prima viremia e in molti casi per fortuna grazie ad una pronta risposta del sistema immunitario arresta l'infezione.
Se siamo al livello dell'epitelio intestinale quali saranno gli anticorpi difensivi introdotti? Saranno quelli di classe IgA. In alcuni rari casi i Poliovirus possono raggiungere il sistema nervoso centrale, sono quelli dotati di neurotropismo, replica nelle cellule nervose, le uccide e di conseguenza il muscolo innervato da quelle cellule nervose non sarà più innervato e da qui ci sarà l'insorgenza di una paralisi flaccida.
Cosa vuol dire “vaccino attenuato di Sabin”? Sabin ha fatto un lavoro un po' da certosino ha preso il poliovirus virulento e con ripetuti passaggi in colture cellulari è arrivato a selezionare un virus che manteneva il proprio ritmo replicativo però aveva perso il neurotropismo (attenuato=vivo in grado di replicarsi però non virulento) questo è stato usato con grande successo. Ah non vi ho detto che il vaccino attenuato di Sabin viene somministrato per via orale, quindi ripercorre esattamente la via seguita dal virus wild type (virus selvaggio).
Se facciamo un paragone tra queste due diverse vaccinazioni il virus di Salk viene somministrato con un iniezione intra muscolo per via sotto cutanea, quindi , arriva nel sangue dove abbiamo le IgG, quindi abbiamo già una diversa risposta anticorpale (IgG Salk e IgA Sabin). Nel caso del vaccino di Salk il virus è morto, è stato inattivato quindi non c'è il rischio che possa retromutare e ritornare ad essere neurotropo e quindi virulento, perché non ci sia nessun rischio deve essere inattivato in maniera corretta. Può essere usato in soggetti immunodeficienti proprio perché non può retromutare e riacquistare la virulenza, quindi da questo punto di vista è molto sicuro, è relativamente economico da preparare e vedremo tra poco cosa vuol dire che non arresta la replicazione del ceppo selvatico cosa che invece sa fare il vaccino attenuato di Sabin.
Questo vaccino come ho già detto è somministrato per via orale determina la formazione di anticorpi però affida la sua replicazione ad un RNA polimerasi RNA dipendente che è un enzima estremamente inaccurato ogni 10 alla 3, 10 alla 6 basi aggiunte fa un errore e mi sembra di avervi anche già detto cosa può comportare questa facilità di errore da parte del RNA polimerasi RNA dipendente, può avere una grave conseguenza nei soggetti immuni-deficienti.
Un bambino sano a cui vengono somministrate un paio di gocce del vaccino di Sabin, produce IgA protettive, il virus non è neurotropo ed eliminerà il virus con le feci, nell'arco di un mese questo bambino sano si libera dal poliovirus di Sabin. Differente è la situazione in cui il vaccino viene somministrato ad un bambino immuno-deficiente, il virus anche in questo caso replica nell'intestino ma proprio perché il bambino è immuno-deficiente nell'arco di un mese non riesce a mettere stop alla replicazione del virus, precede per più tempo, anche per più mesi. Aumenta notevolmente la possibilità che per retromutazione quel virus riacquisti il suo neurotropismo e quindi il vaccino diventa causa di malattia. Quindi, è potenziamene pericoloso in soggetti immuno-deficienti.
È più caro da preparare e conferisce immunità di gruppo, questo vuol dire che quando un bambino è vaccinato con il vaccino di Sabin elimina il virus con le feci e quindi le persone che hanno cura con l'igiene di quel bambino facilmente possono venire a contatto col poliovirus di Sabin che funge da richiamo. Quindi l'immunità di gruppo è dovuta al fatto che persone già vaccinate hanno il richiamo a seguito della vaccinazione di un altra persona. Ovviamente la circolazione del ceppo attenuato entra in competizione con la circolazione del ceppo selvatico cosa che non è realizzata dal vaccino inattivato di Salk che è inattivato e morto.
Proprio per questo rischio in Italia si è usato per molti anni il vaccino di Salk poi si è passati al vaccino di Sabin, poi c'è stata una fase dove venivano utilizzati entrambi: una prima somministrazione con Salk (nessun pericolo perché il virus è ucciso) seguita da due successive dosi di Sabin, come dosi di richiamo somministrate per via orale.
Nei paesi più evoluti tra cui l'Italia c'è stata un ordinanza in Europa mi pare nel 2002 in cui si è deciso visto che il virus può retro-mutare, anche se avviene una volta ogni 2000 dosi... hanno deciso di azzerare totalmente questo rischio e si è ritornati ad impiegare esclusivamente quattro dosi di vaccino inattivato di Salk ed è quello che si fa attualmente in Italia.
I bambini vengono vaccinati a 3 mesi, a 5 mesi, a 11 mesi poi a 5-6 anni con l'ingresso a scuola. Rimane però il vaccino di Sabin un’ottima arma nei paesi sottosviluppati come in India dove la poliomielite è ancora a livello endemico, e quindi è sicuramente più comodo somministrare un vaccino orale, il pericolo che retro-muti è estremamente basso e in condizioni in cui la poliomielite è endemica questo vaccino continua ad avere una grande validità. Quando scompariranno queste zone endemiche e si arriverà ad una capillare somministrazione del virus inattivato in tutto il mondo possiamo immaginare di arrivare ad una eradicazione del poliovirus e questo in quanto l'unico ospite è l'uomo. Si è chiarito recentemente che cosa fa si che il virus di Sabin non sia dotato di neurotropismo.
Questo ci riporta a parlare del nostro punto di partenza che era rappresentato dall'IRES (sito di riconoscimento interno ai ribosomi) che troviamo all'estremità 5' del poliovirus, questo caratteristico ripiegamento che conferisce una struttura secondaria è caratterizzata dalla presenza di 6 loop. Perché questo sito possa legarsi ai ribosomi deve legare vari fattori di trascrizione cellulari, quindi, IRES + fattori di trascrizione cellulari mediano l'aggancio del RNA virale alla subunità 40S dei ribosomi. Quando si va a far crescere il Poliovirus di Sabin in colture cellulari che sono di derivazione nervosa si tratta di neuroblastoma, il virus non cresce. Quello stesso virus coltivato in presenza di cellule intestinali cresce e replica con formazione di una progenie virale. Sequenziando l'IRES è emerso che c'è un amminoacido mutato nel quinto loop, quindi, nel quinto ripiegamento della struttura secondaria che è responsabile dell'assenza di crescita nelle cellule nervose. Questo viene spiegato in questa maniera: vi ho già detto che per dare avvio alla sintesi proteica si devono legare dei fattori di trascrizione cellulare, questa mutazione fa si che nelle cellule nervose un fattore di trascrizione proprio a seguito di questa mutazione non riesce più a combinarsi con l'IRES, arrestando quindi la sintesi proteica. Al contrario questa mutazione non impedisce ai fattori di trascrizione delle cellule intestinali di combinarsi con l'IRES e il virus potrà compiere il suo processo di sintesi proteica arrivando quindi alla formazione di una progenie. Quindi, pensate un’unica mutazione determina a livello dell'IRES l'incapacità, per l'impossibilità che tutti i fattori di trascrizione in maniera appropriata si combinino all'IRES e si ha il blocco della sintesi proteica. Questa mutazione non altera invece l'espressione del virus in cellule intestinali.
Abbiamo visto l'attacco, come avviene l'ingresso del virus in maniera diversa nel Poliovirus e nel Rinovirus, avviene l'uncoting nel Rinovirus che è penetrato per un processo di endocitosi e siamo arrivati al punto che abbiamo un RNA a polarità positiva privo di Cap nel citoplasma, questo deve andare a prendere contatto con i ribosomi.
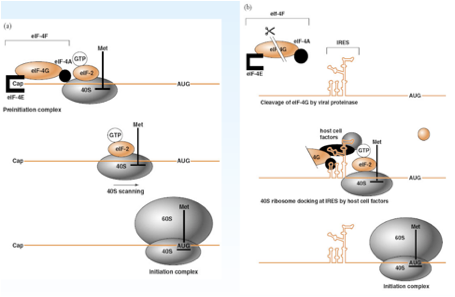
Nella parte sinistra di questa figura abbiamo schematizzato un classico processo di inizio della sintesi proteica, abbiamo il messaggero, abbiamo l'AUG dal quale inizierà la sintesi proteica, il 40S porta il transfer della meteonina, devono concorrere una serie di fattori del processo di traduzione. Questi fattori sono: eIF4E, eIF4G e eIF4A che con la collaborazione del eIF2 carico di GTP formano quello che si chiama complesso di pre-inizio della sintesi proteica. Quando tutto è per bene assemblato la sub-unità 40 S può muoversi sull'RNA messaggero viene richiamata la sub-unità 60S ed ecco che tutto il complesso di inizio è pronto e a partire dall'AUG ha avvio il processo di inizio di sintesi proteica. Qual è il ruolo di tutti questi fattori che vi ho nominato: eIF4G, eIF4A e eIF4E? È quello di mediare il riconoscimento del Cap presente all'estremità 5' del RNA messaggero cellulare. Se andiamo a vedere come si comporta il messaggero virale abbiamo più volte sottolineato che non c'è un Cap e cosa fa per prima cosa il poliovirus? Vuole avere come sempre i ribosomi a propria disposizione vuole fare fuori i messaggeri cellulari in maniera da avvantaggiare la sintesi delle proteine virali, la prima cosa che fa grazie ad una proteasi virale è quello di tagliare eIF4G questo determina che non si assesta il complesso di pre-inizio e questo determina il blocco della sintesi proteica dei messaggeri cellulari. Questo è un colpo violento dice: "tu hai un Cap, ti serve per avviare il tuo processo di sintesi proteica, ecco che io ti taglio questo fattore in due pezzi e blocco automaticamente la traduzione dei messaggeri cellulari". Clivare in due questo fattore a lui non gliene importa niente perché il suo messaggero non ha un Cap. Come avviene allora il riconoscimento tra messaggero virale e la sub-unità 40S? La struttura fondamentale è rappresentata dall'IRES. L'IRES si lega con tantissimi fattori di trascrizione cellulare e lega non solo questi ma utilizza anche un frammento del fattore eIF4G che ha clivato per bloccare i messaggeri cellulari. Una volta che tutti questi fattori si sono assemblati sull'IRES è possibile che il messaggero cellulare venga ancorato alla sub-unità 40S e possa così avere inizio la traduzione di un messaggero che è privo di Cap. Capite immediatamente che l'effetto sulla cellula è drammatico, immediatamente le sintesi proteiche cellulari sono bloccate. Ma non si ferma qui, il Picornavirus è anche in grado di attaccare diverse sub-unità di tutte e tre le primasi cellulari di conseguenza avremo anche l'arresto della sintesi di nuovi messaggeri. Le sintesi macromolecolari di quella cellula sono ko, infatti è un virus che prende il sopravento sulla cellula molto rapidamente, nell'arco di 7-8 ore da già effetto citopatico virus indotto, la cellula si rigonfia poi perde la propria integrità, tant'è che la fuoriuscita di virus in ambiente extracellulare è proprio legata a una rottura della membrana citoplasmatica. Siamo al punto che l'RNA messaggero virale con tutti questi artifizi è stato tradotto e il prodotto di questa traduzione è la formazione di un unico lungo polipeptide. Ovviamente per poter realizzare il proprio ciclo replicativo un’unica proteina non gli basta, solo per fare il capside di proteine gliene servono quattro ed ecco che prima che la sintesi sia completata questa poliproteina viene clivata in tanti pezzi. Chi è che realizza questi tagli? Sono proteinasi presenti nel polipeptide che svolgono la loro funzione catalitica ancora prima di essere tagliate come singoli polipeptidi. In altre parole una porzione della poliproteina assumendo una particolare struttura può funzionare come una proteasi quando è ancora parte del polipeptide.
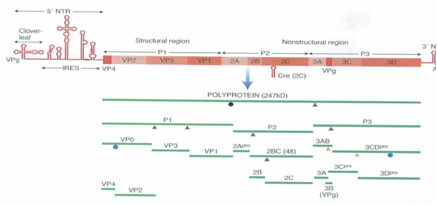
Il primo taglio del polipeptide produce i polipeptidi P1, P2, P3. Dal polipeptide P1 per ulteriori clivaggi si formano da prima 3 proteine strutturali che sono: VP0, VP3 e VP1, poi VP0 sarà tagliata in due: VP2 e VP4, quindi, dalla porzione P1 il risultato finale è la formazione delle quattro proteine strutturali. Dal clivaggio invece di P2 e P3 si formano proteine non strutturali che però svolgono un ruolo determinante nel processo di replicazione. Vi dicevo prima che la proteina 3D è l'RNA polimerasi RNA dipendente mentre nel Rinovirus e anche nel Poliovirus ci sono tre proteine che svolgono attività di proteasi, ossia sono le proteine responsabili dei tagli in maniera che si possano formare tutte le proteine che servono al virus per realizzare la propria replicazione. Sono dotate di attività proteasica la proteina 2A, 3CD e la proteina 3C. Andiamo un po' nei dettagli anche se non so sino a che punto è utile: le proteasi 2A è quella responsabile del primo clivaggio che libera il polipeptide P1 mentre le proteasi 3CD e 3C sono quelle responsabili di tutti i successivi clivaggi che portano il Poliovirus ad avere tutte le proteine che gli servono e questa è la strategia che gli consente: “sono costretto ad essere tradotto come RNA monocistronico? ovviamente un polipeptide solo non mi basta grazie al funzionamento di queste proteasi per tutta una serie di clivaggi a cascata consentono al virus di sintetizzare tutte le proteine che gli necessitano”.
Schema di quanto già visto poco fa:
questo è l'RNA genomico che viene tradotto da prima in una poliproteina che poi viene clivata sia in proteine strutturali, che formeranno il capside sia in proteine enzimatiche tra queste ultima di particolare importanza sono le proteasi che sono quelle che realizzano i vari tagli, e un ruolo fondamentale è quello svolto dal RNA polimerasi, è indispensabile che il virus si sintetizzi una propria RNA polimerasi RNA dipendente perché la cellula ospite non gliela mette a disposizione.
Qual è il ruolo di questa RNA polimerasi?
Sarà quella di utilizzare l'RNA genomico penetrato in quella cellula come stampo per la formazione di una catena di RNA meno che a sua volta servirà da stampo per la formazione di nuovi RNA più che potranno svolgere il ruolo di messaggeri o di genoma della progenie virale che si libera da quella cellula.
Siamo arrivati al punto che il genoma è stato tradotto, si è arrivati alla sintesi di proteine strutturali ed enzimatiche e vi ho appena finito di dirvi che il protagonista della replicazione nei Picornavirus è l'RNA polimerasi RNA dipendente che ha il compito di formare nuovi genomi a RNA e anche quello di formare nuovi RNA messaggeri. Dove avviene la replicazione dei Picorna virus? Prima di tutto diciamo che hanno la capacità come molti altri RNA virus di indurre la formazione di vescicole che si formano nel reticolo endoplasmatico. Queste vescicole virus indotte servono a localizzare tutto quanto serve perché si possano assemblare i complessi di replicazione ed è proprio nella superficie di queste vescicole membranose che si concentra tutto quanto è indispensabile perché il virus possa replicare. Si cominciano ad avere molti dettagli sui ruoli svolti dai vari polipeptidi che i Picornavirus sintetizzano, i prodotti del clivaggio 2B, 2C e 3A sono ritenuti responsabili della formazione di queste vescicole. Ma non partecipano soltanto alla formazione dei complessi di replicazione soltanto le proteine virali, il virus sfrutta al massimo la cellula e concorrono in questi processi anche proteine cellulari.
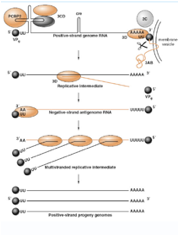
Se partiamo dall'estremità 5' vediamo che il primo ripiegamento della struttura secondaria ha una forma che può ricordare quella di un quadrifoglio, ed ecco che questo ripiegamento lega un polipeptide virale che è la proteina 3CD però lega anche una proteina cellulare PCBP2 è una proteina ricca in pirimidine che è capace di interagire con questa struttura secondaria presente all'estremità 5' e concorre con il 3CD ed ha la funzione di avvicinare il genoma virale alle vescicole che il virus ha indotto. Abbiamo detto che 3CD con questa proteina cellulare ha il compito di veicolare l'RNA in prossimità delle membrane delle vescicole, sempre in questa prossimità viene legata la proteina 3AB. Questa proteina è formata da 3 porzioni che vengono successivamente clivate: la porzione 3A ha la funzione di legare il genoma alla vescicole, mentre la porzione 3B è la proteina VPg che abbiamo visto presente nel RNA virale legata all'estremità 5'.
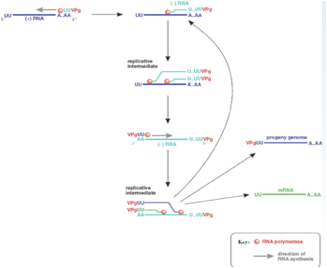
Questa proteina VPg è importante e la troviamo in tutti i genomi in quanto l'RNA polimerasi RNA dipendente per funzionare ha bisogno di un innesco che gli viene fornito dalla proteina VPg. Questa piccola proteina tramite un residuo di tirosina è legata ad una corta coda di poli-A. Quindi, abbiamo la VPg con la sua corta coda di poli-U che per complementarietà si lega alla coda di poli-A presente in posizione 3' nel RNA a polarità positiva e si forma un Cap che la polimerasi può utilizzare per estendere e per trascrivere una catena a polarità meno. Abbiamo a seguito del clivaggio del precursore 3AB viene liberata la proteina 3B che è la proteina Vpg caratteristicamente presente all'estremità 5' del genoma dei Picornavirus.
Qual è il ruolo di questa proteina? È quello di fungere da innesco per il funzionamento dell'RNA polimerasi RNA dipendente.
Come funzionano le cose? La proteina Vpg porta legata una corta coda di poli-U questa per complementarietà si lega alla coda di poli-A presente nell'RNA a polarità positiva e si crea cosi un innesco che può essere utilizzato dal RNA polimerasi per copiare la catena più e formare una catena complementare di segno meno. Si è formata una catena a polarità negativa, ancora una volta la proteina VPg funge da innesco e la polimerasi può adesso copiare questa catena negativa per formare nuove catene a polarità positiva. L'efficienza con cui questa catena meno viene copiata in più è molto molto elevata. Si è contatto che all'interno di una cellula infettata per esempio da Polio c'è una catena a polarità negativa e 40 catene a polarità positiva. Questo dipende anche dal fatto che come l'RNA polimerasi comincia a scorrere in una catena a polarità negativa per sintetizzare una nuova catena più non ha ancora finito di trascrivere che un altra attività enzimatica comincia a svolgere lo stesso lavoro. In poche parole più molecole dell'enzima leggono in contemporanea lo stesso stampo a polarità negativa e questo avvantaggia la formazione di nuove catene a polarità positiva. Siamo arrivati alla formazione di catene a polarità positiva sono partite con un innesco che conteneva la proteina VPg tutte le molecole neo-sintetizzate hanno questa proteina all'estremità 5'.
Qual è il destino di queste molecole a polarità positiva? È triplice.
La catena a polarità positiva funge da stampo per la formazione di molecole a polarità negativa che serviranno a loro volta per la formazione di nuovi RNA più che possono, perdendo per clivaggio la proteina VPg, fungere da RNA messaggeri, possono fungere mantenendo VPg da genomi della progenie virale come pure possono fungere da stampo per la formazione di RNA meno amplificando la produzione di RNA. Quindi, triplice destino:
• RNA messaggeri, aumenta la quantità di proteine virali sintetizzate nella cellula;
• possono fungere da genoma della progenie;
• possono fungere da stampo per l'ulteriore formazione di RNA negativi a loro volta stampo per la formazione di nuove catene più;
Siamo arrivati a sintetizzare nuovi genomi abbiamo visto che nel frattempo si sono sintetizzate le proteine strutturali, il virus è pronto ad assemblarsi. Particelle mature ed infettanti si accalcano nel citoplasma, il risultato è che la cellula esplode ed il virus viene liberato in ambiente extra-cellulare.
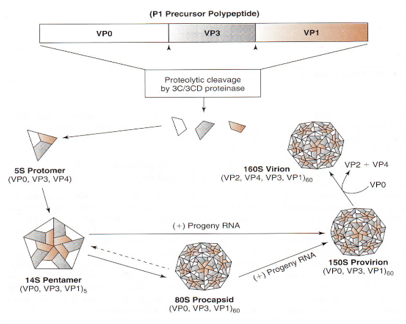
Come avviene questo assemblaggio? Vediamo in maniera sintetica, abbiamo visto che le proteine strutturali sono quattro: VP1, VP2, VP3 e VP4. E la sintesi delle proteine strutturali parte dal clivaggio del segmento proteico P1 si formano da prima per clivaggio le proteine VP0, VP3 e VP4, queste si assemblano a formare un protomero che ha un coefficiente di sedimentazione di 5 Svedberg (S), ecco che poi si assemblano 5 di questi protomeri a formare una struttura a forma di pentamero che ha un coefficiente di sedimentazione di 14S, questa è una struttura base che concorre alla formazione del capside.
A questo punto per arrivare ad una particella virale completa sono ancora in piedi due teorie:
• la prima (parte bassa figura) dice che questi pentameri 14 S si uniscono tra loro a formare un nucleo proteico vuoto al quale viene dato il nome di pro-capside. Successivamente l'RNA entra in quanto pro-capside e si forma un pro-virion;
• l'altra teoria dice che non esiste il pro-capside i pentameri 14S si assemblano ntorno al RNA e in questo caso si forma direttamente un pro-virion 150S.
Ricordo con piacere questo processo di morfogenesi del Poliovirus in quanto è stato argomento della mia tesi. Lavorando con Prof. La Colla si era messo in evidenza che il pro-capside è un artefatto tecnico. Il pro-capside in realtà in natura non esiste viene preparato in laboratorio durate la preparazione degli estratti e come via alternativa avevamo dimostrato che il contagio avviene grazie all'assemblaggio diretto dei pentameri 14S intorno al RNA genomico. Una volta che si è arrivati alla formazione del pro-virion si ha il clivaggio della proteina VP0 in VP2 e Vp4 in modo che si abbiamo tutte e quattro le proteine strutturali che caratterizzano una particella completa di Picornavirus. Dopo di che si ha morte della cellula, liberazione di particelle virali in ambiente extra-cellulare.
Abbiamo visto come il Rinovirus replica, ci mancano ancora due cose:
• come si trasmette;
• come evade le difese dell'ospite.
Come l'influenza e come vedremo giovedì il virus del morbillo anche il Rinovirus è trasmesso tramite colpi di tosse, starnuti ed è un virus trasmesso per via respiratoria.
Vi dicevo prima che i recettori in grado di legare i Rinovirus sono presenti nei polmoni.
Perché si localizza soltanto a livello dell'epitelio nasale?
Dipende dal fatto che il capside del Rinovirus, ma non di altri Picornavirus, predilige una temperatura più bassa rispetto a quella corporea, nel naso la temperatura si aggira tra i 33-34 gradi, questa temperatura stabilizza il capside e giustifica la stabilizzazione del virus in questa sede anatomica. Per quanto riguarda il tipo di infezione acuta non cronicizza, grazie alla risposta dell'immunità innata la guarigione solitamente si realizza nell'arco di 4-5 giorni.
Se il raffreddore ci attacca, il nostro sistema immuno competente non rimane lì come un baccalà a sopportare la replicazione del virus, ma scende in campo con delle difese. Abbiamo più volte sottolineato che un’arma dell'immunità innata, soprattutto nel caso delle infezioni virali, è rappresentata dall'interferon, però il Rinovirus non è un ottimo produttore di interferone. Poco fa vi dicevo che per mettere vicine tutte le cose che servono per formare un complesso di replicazione, induce a livello del reticolo endoplasmatico la formazione di vescicole che si accompagna all'arresto di quello che è il normale traffico di molecole dal reticolo endoplasmatico al Golgi e dal Golgi alla membrana citoplasmatica. La formazione delle vescicole arresta il processo secretorio della cellula di conseguenza se l'interferon viene prodotto non potrà essere veicolato all'esterno.
Vi ricordate che deve essere portato all'esterno della cellula che l'ha prodotto per andare ad allertare le cellule vicine. Quindi, il Rinovirus distrugge il sistema di trasporto dall'interno all'esterno della cellula. Inoltre c'è anche un altro meccanismo che il Rinovirus attenua che è la produzione di interferone all'interno della cellula che sta infettando, interferendo con l'attivazione del fattore IRF3, questo è l'enhancer a monte del gene dell'interferone. Dovevano essere attivati tanti fattori di trascrizione per potersi avviare la produzione di interferone uno di questi fattori è IRF3, per potersi collocare correttamente nel sito di regolazione positiva in questo enhancer l'IRF3 deve essere attivato e il Rinovirus blocca l'attivazione. Quindi, da una parte abbiamo: “si fa un po' di interferone?” viene bloccato il suo trasporto perché sono state indotte le vescicole, dall'altra però la produzione di interferone è anche controllata a livello della sua produzione che è scarsa perché manca l'attivazione del fattore IRF3. Quindi, è molto meno importante la produzione di interferone che svolge un ruolo determinante per difenderci dall'infezione influenzale. Chi porta a guarigione è una vera e propria risposta rapida del sistema immunocompetente. È un virus che realizza in fretta la propria replicazione e poi scappa in quanto è bloccato in una sua ulteriore replicazione dalle difese di tipo innato: complemento, macrofagi e natural Killer, il funzionamento di queste difese è sufficiente ad arginare la replicazione del Rinovirus, tant’è vero che il sistema immunitario di tipo adattativo non viene attivato.
La risposta immunitaria al rinovirus
Possiamo fare un paragone tra Rinovirus e influenza:
• la risposta innata nel caso dell'influenza non è in grado di arginare la risposta del virus. Grazie all'intervento delle cellule dendritiche potrà essere attivata una risposta di tipo adattativo con la produzione di linfociti T citotossici e anticorpi responsabili di risolvere l'infezione. Quindi, ci vuole più tempo perché tutto questo si metta in moto e il nostro sistema immuno competente riesca a controllare l'infezione virale.
Guardate come è differente il quadro di conseguenza all'infezione da Rinovirus la risposta innata (macrofagi, complemento, natural Killer) riescono da soli ad abbattere il numero di virus infettanti e si può arrivare a non avere attivazione di una risposta adattativa. Questo al virus conviene perché se non si formano gli anticorpi la risposta adattativa non viene chiamata in causa e di conseguenza lo stesso sierotipo di Rinovirus potrà più volte infettare lo stesso soggetto, ciò non accadrebbe nel caso in cui ci sarebbero anticorpi pronti per bloccare una seconda esposizione al virus.
Altra arma che sfrutta ancora una volta anche lui è un RNA polimerasi RNA dipendente, abbiamo come nel caso dell'influenza una deriva antigenica tanto è vero che in circolazione sierotipi di Rinovirus ce ne sono un centinaio. E questo rende piuttosto improbabile che si possa arrivare a sviluppare un vaccino. Vi ho parlato di antigenic drift quindi mutazioni che si ripercuotono nella superficie della particella virale...
Secondo voi è possibile che ci sia anche un antigenic shift o cambiamento antigenico?
Che differenza c'era tra antigenic shift e drift?
Una deriva antigenica è l'introduzione di mutazioni che si ripercuotono ad esempio nella struttura dell'emoagglutinina, quindi la struttura antigenica cambia e gli anticorpi precedentemente formati non neutralizzano più quella glicoproteina. Invece compare un virus nuovo in quanto ad esempio nell'influenza il genoma è fatto da 8 pezzi , un virus aviario e uno umano possono incontrarsi ad esempio nel maiale si ha un rimaneggiamento e alla loro superficie, si ha il rimaneggiamento ed ecco che alla loro superficie è espressa ad esempio in un virus umano un emoagglutinina di origine aviaria, un antigene complementare nuovo che non ha mai circolato nella popolazione umana che causa una pandemia.