Coenzimi piridinici
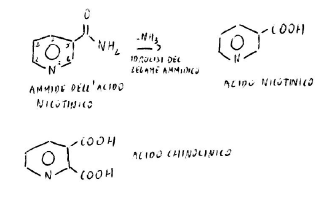
Gli enzimi che si occupano della sintesi si interrompono solo se ci sono COOH.
Prima di arrivare alla ipovitaminasi, l’organismo trasforma il triptofano in acido chinolinico da usare per la sintesi del coenzima.
Nel sito catalitico hanno Mn(II) che con legame assiale riceve un doppietto da O legato in 1C (riboso-5-fosfato-1-pirofosfato). Il legame passa da dativo a covalente: i due elettroni vengono presi da O, 1C rimane cationico e subisce attacco nucleofilo da N.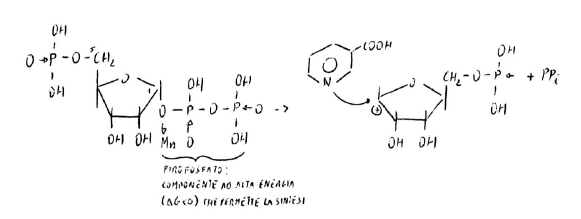
Base azotata, monosaccaride (riboso), fosfato: ci sono i tre componenti di un nucleotide.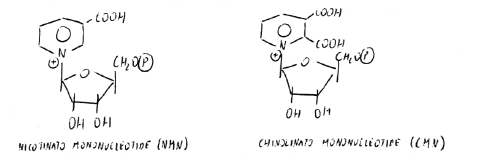
CMN in presenza di Mn-proteina (riconosce se la molecola ha 2 COOH): gli O di COOH sono assiali rispetto a Mn, che li lega in maniera covalente e li stacca. CMN si decarbossila diventando NMN.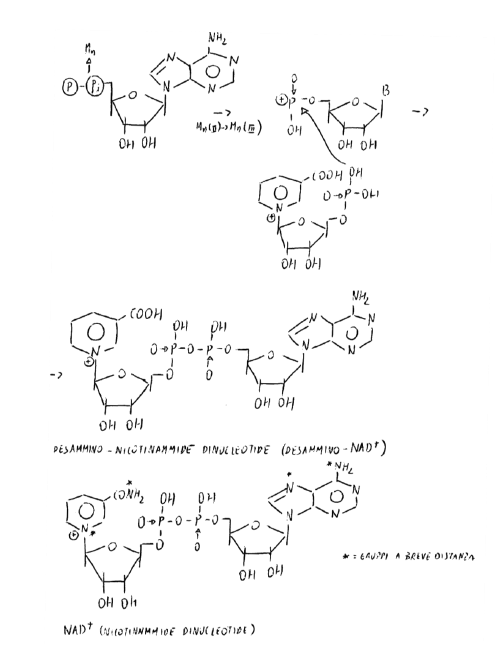
NAD+ + ATP → ADP + NADP+
Ossidoriduttasi-NAD+ dipendenti nei mitocondri.
Ossidoriduttasi-NADP+ dipendenti nel citoplasma.
Il riconoscimento e il legame non è di tipo ionico.
La struttura è ripiegata in modo che i due eterocicli si trovino su piani paralleli affacciati in modo che i gruppi azotati siano a breve distanza.
Mg o Ca sono metalli-cofattori: hanno coordinazione pari a 4 con gli N, e il loro ruolo (senza cui il meccanismo non funziona) è quello di promuovere la transizione delle due basi azotate da forma lattimica a semilattamica.
NADP+ → NADPH + H+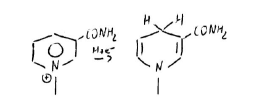
Il sostituente in 3 porta ad assestamento cationico in 1C, l’unico che può accettare o cedere unità riducenti: dal donatore a se stesso se funge da accettore, da se stesso all’accettore se funge da donatore.
Continua a leggere:
- Successivo: Effetto catalitico
- Precedente: Ossidoriduttasi
Dettagli appunto:
-
Autore:
Marco Lazzara
[Visita la sua tesi: "Determinazione di arsenico mediante voltammetria di stripping anodico con elettrodo in oro"]
[Visita la sua tesi: "I laser a coloranti: fondamenti e stato dell'arte"]
- Università: Università degli Studi di Torino
- Facoltà: Scienze Matematiche, Fisiche e Naturali
- Corso: Chimica
- Esame: Biochimica
- Docente: Carlo Giunta
Altri appunti correlati:
- Biochimica
- Fondamenti di chimica
- Appunti di Biochimica
- Catecolamine e glucagone
- Chimica Analitica Strumentale (Spettroscopia)
Per approfondire questo argomento, consulta le Tesi:
- Analisi dei nitriti attraverso il loro impiego nell’industria alimentare e applicazione di un’indagine percettiva sui consumatori
- Meccanismi biochimici ed effetti sulla salute umana del licopene
- Studio dei processi di degrado su manufatti archeologici in ambiente marino sommerso e sperimentazione di procedure innovative per la conservazione in situ
- Bio-lubricant from the olive mill waste through a new biocatalyst immobilized on ZnFe2O4
- Rational Design and Synthesis of Novel Acadesine-Like Modulators of AMPK
Puoi scaricare gratuitamente questo appunto in versione integrale.


