Peptidasi
Scindo legami peptidici.
Possono essere amminopeptidasi (partono dall’estremo 1N1) o carbossipeptidasi (partono dall’estremo αCn).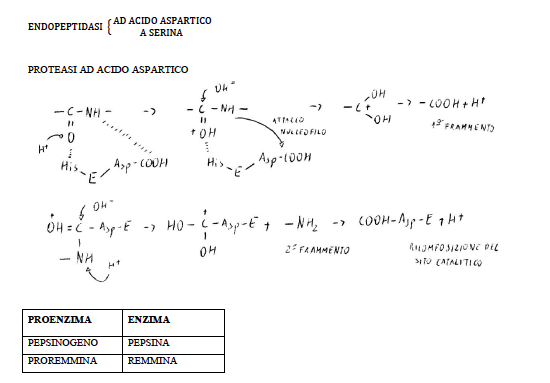
Il passaggio da proenzima ad enzima avviene spontaneamente attraverso meccanismo di pompe ioniche a CO32-/Cl-, che con lo scambio di H+ producono HCl (nello stomaco dei mammiferi).
A pH < 3 cambiano conformazione in modo da togliere l’elemento di protezione, e l’enzima si attiva.
La proteina è scindibile in base ai residui amminoacidici posti di fronte all’acido aspartico.
La pepsina è meno efficiente, in quanto ha un sito attivo abbastanza plastico che si adatta a varie situazioni: riconosce l’amminoacido donatore di NH2 per primo se è aromatico (in pochi minuti), poi se è ramificato (20-25 minuti), infine se è dicarbossilico (mezz’ora - tre quarti d’ora).
La remmina è più selettiva, in quanto ha un sito catalitico rigido che riconosce solo come donatore di NH2 la metionina.
Le proteine assunte attraverso gli alimenti vengono disgregate dalla pepsina.
La remmina si occupa della metionina inserita in sequenze Met-Ala-(Ser/Thr)2/3-Gly~~~Asp. Ser/Thr e Asp sono sede di glicosilazione, inserzione di catene oligosaccaridiche ramificate, che si trovano nei caseinogeni (latte). La remmina opera taglio e rimozione dei frammenti glicopeptidici, e i caseinogeni in soluzione precipitano come caseine, che possono essere aggredite dalla pepsina.
Continua a leggere:
- Successivo: Proteasi a serina
- Precedente: Glucosidasi
Dettagli appunto:
-
Autore:
Marco Lazzara
[Visita la sua tesi: "Determinazione di arsenico mediante voltammetria di stripping anodico con elettrodo in oro"]
[Visita la sua tesi: "I laser a coloranti: fondamenti e stato dell'arte"]
- Università: Università degli Studi di Torino
- Facoltà: Scienze Matematiche, Fisiche e Naturali
- Corso: Chimica
- Esame: Biochimica
- Docente: Carlo Giunta
Altri appunti correlati:
- Biochimica
- Fondamenti di chimica
- Appunti di Biochimica
- Catecolamine e glucagone
- Chimica Analitica Strumentale (Spettroscopia)
Per approfondire questo argomento, consulta le Tesi:
- Analisi dei nitriti attraverso il loro impiego nell’industria alimentare e applicazione di un’indagine percettiva sui consumatori
- Meccanismi biochimici ed effetti sulla salute umana del licopene
- Studio dei processi di degrado su manufatti archeologici in ambiente marino sommerso e sperimentazione di procedure innovative per la conservazione in situ
- Bio-lubricant from the olive mill waste through a new biocatalyst immobilized on ZnFe2O4
- Rational Design and Synthesis of Novel Acadesine-Like Modulators of AMPK
Puoi scaricare gratuitamente questo appunto in versione integrale.


