Coenzimi flavinici
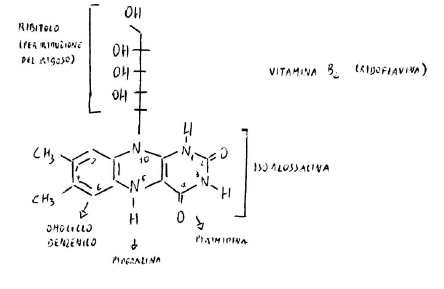
La trasformazione nel coenzima avviene per fosforilazione. Il ribitolo si presta bene ad essere fosforilato: esistono enzimi in grado di mobilitare il fosforile dall’ATP all’OH in 5’ del ribitolo.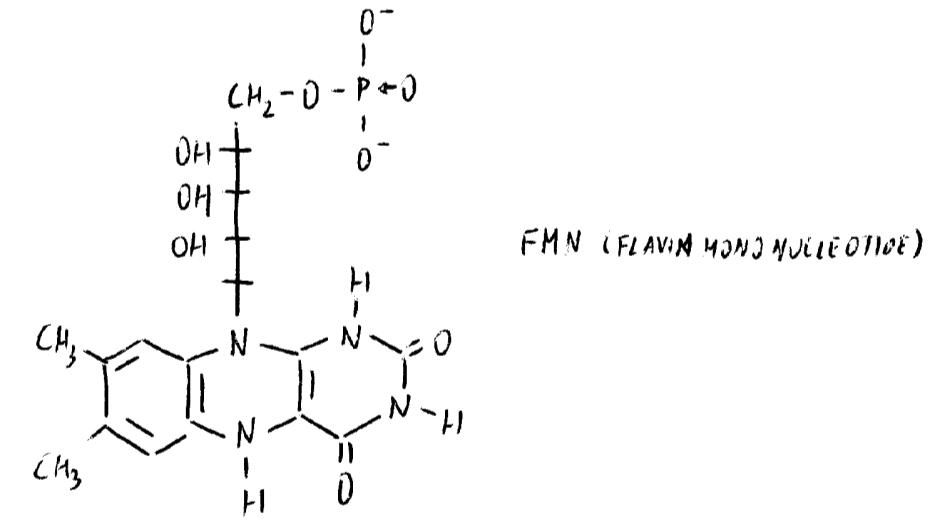
È presente non un saccaride, ma un prodotto di trasformazione di un saccaride per riduzione, c’è un gruppo fosforico e una base azotata: quindi è un nucleotide.
È un coenzima extramitocondriale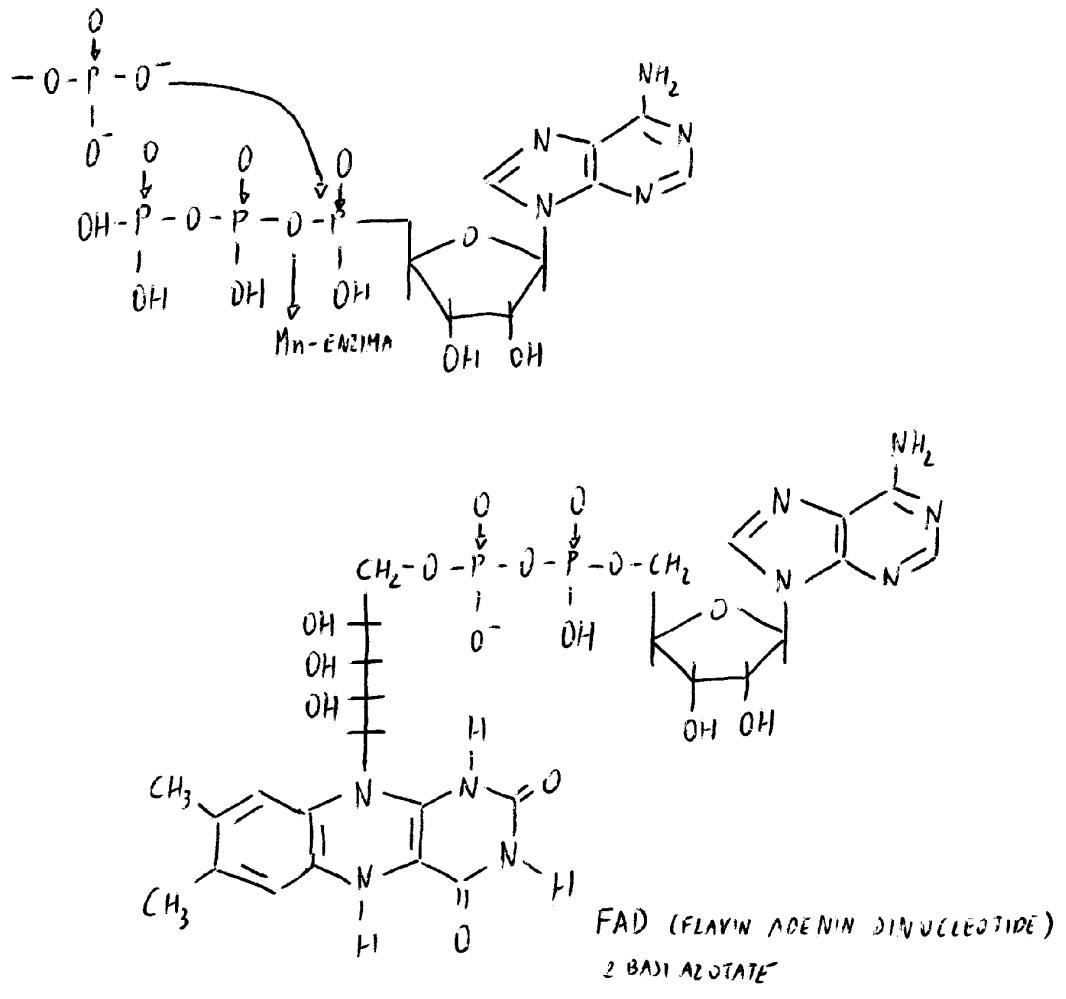
Il FAD occupa lo spazio intramitocondriale. Gli enzimi FAD-dipendenti hanno quindi distribuzione intramitocondriale.
rF (RIBOFLAVINA) + ATP → ADP + FMN
FMN + ATP → FAD + PPi
Il legame non è solo di tipo salino, ma ci sono anche interazioni deboli apolari che fanno in modo che il coenzima si associ al sito catalitico della proteina.
Il cambio dello stato di ossidazione non incide sulla costante di dissociazione tra coenzima e proteina: quindi il coenzima non abbandona l’apoproteina.
I due metili possono dare legami covalenti. Se ad amminoacidi ossidrilati come serina o treonina vengono rimossi gli ossidrili da un metallo di transizione, il C a cui erano legati diventa cationico, e i metili della flavina possono dare attacco nucleofilo su di esso per formare ponti metilenici.
Continua a leggere:
- Successivo: Interazioni col sito attivo
- Precedente: Interazioni con l’ossigeno (reazioni ossigenasiche)
Dettagli appunto:
-
Autore:
Marco Lazzara
[Visita la sua tesi: "Determinazione di arsenico mediante voltammetria di stripping anodico con elettrodo in oro"]
[Visita la sua tesi: "I laser a coloranti: fondamenti e stato dell'arte"]
- Università: Università degli Studi di Torino
- Facoltà: Scienze Matematiche, Fisiche e Naturali
- Corso: Chimica
- Esame: Biochimica
- Docente: Carlo Giunta
Altri appunti correlati:
- Biochimica
- Fondamenti di chimica
- Appunti di Biochimica
- Catecolamine e glucagone
- Chimica Analitica Strumentale (Spettroscopia)
Per approfondire questo argomento, consulta le Tesi:
- Analisi dei nitriti attraverso il loro impiego nell’industria alimentare e applicazione di un’indagine percettiva sui consumatori
- Meccanismi biochimici ed effetti sulla salute umana del licopene
- Studio dei processi di degrado su manufatti archeologici in ambiente marino sommerso e sperimentazione di procedure innovative per la conservazione in situ
- Bio-lubricant from the olive mill waste through a new biocatalyst immobilized on ZnFe2O4
- Rational Design and Synthesis of Novel Acadesine-Like Modulators of AMPK
Puoi scaricare gratuitamente questo appunto in versione integrale.