Degradazione di Edman
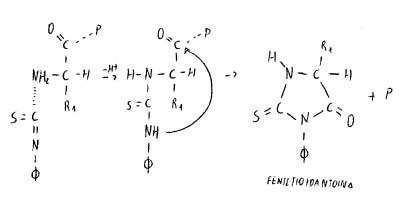
Dal peptide di partenza otteniamo la feniltioidantoina, che si forma dopo che N ha staccato il primo amminoacido, e un peptide (P) che è quello originale ma senza il primo amminoacido (quello che era il 2° amminoacido diventa quello terminale). Se il feniltioisocianato viene messo in eccesso stacca tutti gli amminoacidi uno dopo l’altro.
COPULAZIONE: CAMERA DOVE È MESSO IL PEPTIDE E DOVE SI INSERISCE IL FENILTIOISOCIANATO IN AMBIENTE ANIDRO CON CF3COOH
⇩
PRELEVAMENTO: PRELIEVO DI UN CAMPIONE SOTTO FORMA DI FENILTIOIDANTOINA
⇩
IDENTIFICAZIONE: IL CMAPIONE VIENE MANDATO A UNO SPETTROFLUORIMETRO (OGNI aa HA UNO SPETTRO DIVERSO A SECONDA DI R) E POI VIENE ELABORATO (CIÒ PER OGNI aa)
DIFFICOLTÁ = 1° CICLO: 1° IDANTOINA
2° CICLO: 1° + 2° IDANTOINA (LO SPETTRO SI COMPLICA)
Elaboratori elettronici risolvono il problema: l’informazione spettrofluorimetrica viene memorizzata e successivamente sottratta.
Si possono fare misure fino a lunghezze di catena anche di più di un centinaio di amminoacidi.
Prove anche attraverso la spettrometria di massa.
Si usa una preventiva frammentazione per via chimica o enzimatica delle proteine progettata in modo da avere parti in comune che si sovrappongono.
Usando come fattore di prevenzione la tripsina, questa taglia solo dove l’amminoacido che impegna 1C è ad esempio il triptofano; usando il bromuro di cianogeno taglia solo se è la metionina.
Continua a leggere:
- Successivo: Struttura primaria del peptide o proteina
- Precedente: Struttura delle proteine
Puoi scaricare gratuitamente questo appunto in versione integrale.