La transamminazione
Le reazioni di amminotransferasi avvengono in due stadi:
1.Il gruppo amminico di un amminoacido viene trasferito sull'enzima, producendo il chetoacido corrispondente e l'enzima amminato:
amminoacido + enzima 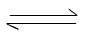 α-chetoacido + enzima-NH2
α-chetoacido + enzima-NH2
2.Il gruppo amminico viene trasferito al chetoacido accettore (per es. α-chetoglutarato) producendo l'amminoacido (per es. glutammato) e rigenerando l'enzima:
α-chetoglutarato + enzima-NH2 enzima + glutammato
enzima + glutammato
Per poter trasportare il gruppo amminico, le amminotransferasi richiedono la partecipazione di piridossal-5'-fosfato (PLP) un derivato della vitamina B6. Il gruppo amminico viene sistemato mediante la conversione di questo coenzima a piridossammina-5'-fosfato (PMP). PLP viene attaccato covalentemente all'enzima tramite un collegamento di tipo base di Schiff (immina) formato dalla condensazione del suo gruppo aldeidico con il gruppo amminico di un residuo di Lys enzimatico.
In questo modo lo stadio I della transamminazione in cui abbiamo la conversione dell'amminoacido a chetoacido procederà in tre reazioni:
1.Il gruppo amminico nucleofilico dell'amminoacido attacca l'atomo di carbonio dell'enzima-PLP base di Schiff in una reazione di transimminazione (trans-Schiffizzazione) che forma un amminoacido-PLP base di Schiff con il concomitante rilascio del gruppo amminico di Lys dell'enzima;
2.L'amminoacido-PLP base di Schiff tautomerizza ad un α-chetoacido-PMP base di Schiff mediante rimozione dell'idrogeno α dell'amminoacido e protonazione dell'atomo C(4') di PLP attraverso un intermedio carbanionico stabilizzato dalla risonanza;
3.L'α-chetoacido-PMP base di Schiff viene idrolizzato a PMP e ad α-chetoacido;
Per completare il ciclo catalitico dell'amminotransferasi il coenzima deve essere convertito da PMP di nuovo nell'enzima-PLP basi di Schiff. Tutto questo avviene nello stadio II in cui abbiamo la conversione di un α-chetoacido ad amminoacido:
1.PMP reagisce con un α-chetoacido formando una base di Schiff;
2.L'α-chetoacido-PMP base di Schiff tautomerizza formando un amminoacido-PLP base di Schiff;
3.Il gruppo amminico di un residuo di Lys attacca l'amminoacido-PLP base di Schiff in una reazione di transamminazione che rigenera l'enzima attivo-PLP base di Schiff con liberazione di un amminoacido di nuova formazione:
amminoacido1 + α-chetoacido2  α-chetoacido1 + amminoacido2
α-chetoacido1 + amminoacido2
La gran parte delle ammino transferasi accetta solo α-chetoglutarato o (in misura minore) ossalacetato come l'α-chetoacido substrato nel secondo stadio della reazione generando glutammato o aspartato come i loro unici prodotti amminoacidici. I gruppi amminici della maggior parte degli amminoacidi sono di conseguenza attivati nella via di formazione di glutammato e aspartato, che sono reciprocamente interconvertiti dalla glutammato-aspartato amminotransferasi:
glutammato + ossalacetato  α-chetoglutarato + asparato
α-chetoglutarato + asparato
La deamminazione ossidativa del glutammato genera ammoniaca e rigenera α-chetoglutarato per un altro ciclo di reazioni di transamminazione. Ammoniaca e aspartato sono i due donatori di gruppi amminici nella sintesi dell'urea.
LA DEAMMINAZIONE OSSIDATIVA: LA GLUTAMMATO DEIDROGENASI
Il glutammato viene deamminato in modo ossidativo nel mitocondrio ad opera della glutammato deidrogenasi, l'unico enzima conosciuto che può accettare o NAD+ o NADP+ come suo coenzima di ossidoriduzione. Si ritiene che l'ossidazione avvenga con il trasferimento di uno ione idruro dal Cα del glutammato a NAD(P)+, con la formazione quindi di α-imminoglutarato, che viene idrolizzato ad α-chetoglutarato e ammoniaca.
Continua a leggere:
- Successivo: Il ciclo dell'urea
- Precedente: La deamminazione degli amminoacidi
Dettagli appunto:
- Autore: Domenico Azarnia Tehran
- Università: Università degli Studi di Roma La Sapienza
- Facoltà: Scienze Matematiche, Fisiche e Naturali
- Corso: Scienze Biologiche
- Esame: Chimica biologica
- Titolo del libro: Biochimica
- Autore del libro: Donald Voet e Judith G. Voet
- Editore: Zanichelli
- Anno pubblicazione: 1993
Altri appunti correlati:
- Fisiologia della nutrizione
- Biologia molecolare
- Biochimica
- Struttura molecolare delle proteine
- Scienze e tecniche dietetiche applicate
Per approfondire questo argomento, consulta le Tesi:
- Crescita di Chlorella vulgaris in acque reflue da vinificazione: studio della cinetica di crescita e del contenuto in lipidi
- Evidenze nutrizionali per il recupero muscolare nell'atleta di endurance
- The role of CARMA2/CARD14 in NF-kB activation signalling
- Caratterizzazione delle specie ittiche di basso valore commerciale del Golfo di Manfredonia
- Approcci Sistemici e Transdisciplinari per la Gestione a lungo termine del Sovrappeso e dell’Obesità
Puoi scaricare gratuitamente questo riassunto in versione integrale.

