Inibizione enzimatica competitiva
Un composto che compete direttamente con un substrato normale di un enzima per l'acceso al sito di legame viene chiamato inibitore competitivo. Questo tipo di inibitore di solito è molto simile al substrato per quella porzione che si lega in modo specifico al sito attivo dell'enzima e ne differisce per non essere reattivo. Il modello generale dell'inibizione competitiva ci è fornito dal seguente schema di reazione: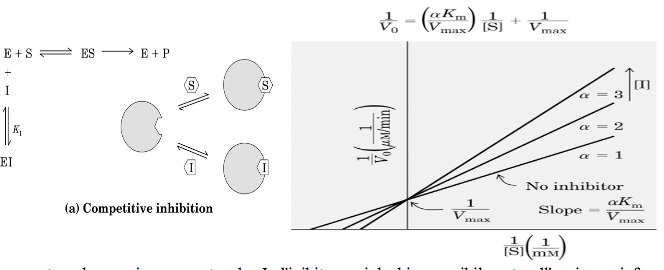
In questo schema viene assunto che I, l'inibitore, si leghi reversibilmente all'enzima, si formi rapidamente l'equilibrio, sia valida la relazione KI = [E][I]/[EI], e il complesso enzima-inibitore EI sia cataliticamente inattivo. Un inibitore competitivo agisce quindi diminuendo la concentrazione di enzima libero disponibile al legame del substrato. É interessante confrontare l'equazione che descrive il caso di assenza di inibizione (equazione di Michaelis-Menten) con l'equazione per la velocità della reazione enzimatica in presenza di una concentrazione fissa di inibitore competitivo I:
v0 = Vmax[S]/KM+[S]
v = Vmax[S]/[S]+KM(1+[I]/KI)
Nel caso dell'inibizione al denominatore il termine KM è annullato di un fattore α:
α = 1+[I]/KI
L'equazione di Michaelis-Mente in cui la KM viene modulata da α, in funzione della concentrazione dell'inibitore, è:
v = Vmax[S]/αKM+[S]
Il valore di [S] quando v0 = Vmax/2 corrisponde a αKM. Trasformando quest'ultima equazione di Michaelis-Menten dipendente dall'inibitore, in forma di doppi reciproci, otteniamo:
1/v0 = (αKM/Vmax) 1/[S] + 1/Vmax
in un grafico (vedere grafico sopra) questa equazione rende una retta, la cui pendenza è αKM/Vmax, l'intercetta sull'asse 1/[S] è -1/αKM e l'intercetta sull'asse 1/v0 è 1/Vmax. Il grafico dei doppi reciproci per un inibitore competitivo, ripetuto a varie concentrazioni di I, presenta diverse caratteristiche:
all'aumentare della concentrazione di I, la velocità decresce (1/v0 aumenta);
quando [S] diviene infinitamente grande, v=Vmax e quindi non è influenzata da I perché tutto l'enzima è nella forma ES;
più grande è il valore di α e più elevata deve essere la concentrazione di [S] necessaria per poter raggiungere la Vmax;
la Vmax non è influenzata da I, infatti tutte le rette mostrano la stessa intercetta sull'asse y. Questo fatto è specifico per l'inibizione competitiva e può essere usato per distinguere l'inibizione competitiva da altri tipo di inibizione;
Un esempio di inibizione competitiva ci è fornito dall'enzima succinato deidrogenasi (COO-—CH2—CH2—COO-) (SDH, substrato) che è inibito competitivamente dal malonato (COO-—CH2—COO-). Substrato: succinato SDH prodotto: fumarato inibitore competitivo: malonato
COO-—CH2—CH2—COO- -------> COO-—CH=CH—COO- COO-—CH2—COO-
La similarità tra i due composti è alla base della capacità del malonato di mimare il succinato e legarsi al sito attivo della SDH. A differenza del succinato che viene ossidato a fumarato dalla SDH, il malonato non può perdere due atomi di H e di conseguenza non è reattivo. Un altro esempio di inibizione competitiva è quello del metotrexato un inibitore competitivo della diidrofolato reduttasi. Il metotrexato, quando viene somministrato nelle opportune dosi, uccide le cellule cancerose senza danneggiare letalmente le cellule dell'ospite.
Continua a leggere:
- Successivo: Inibizione enzimatica incompetitiva
- Precedente: Inibizione enzimatica
Dettagli appunto:
- Autore: Domenico Azarnia Tehran
- Università: Università degli Studi di Roma La Sapienza
- Facoltà: Scienze Matematiche, Fisiche e Naturali
- Corso: Scienze Biologiche
- Esame: Chimica biologica
- Titolo del libro: Biochimica
- Autore del libro: Donald Voet e Judith G. Voet
- Editore: Zanichelli
- Anno pubblicazione: 1993
Altri appunti correlati:
- Fisiologia della nutrizione
- Biologia molecolare
- Biochimica
- Struttura molecolare delle proteine
- Scienze e tecniche dietetiche applicate
Per approfondire questo argomento, consulta le Tesi:
- Crescita di Chlorella vulgaris in acque reflue da vinificazione: studio della cinetica di crescita e del contenuto in lipidi
- Evidenze nutrizionali per il recupero muscolare nell'atleta di endurance
- The role of CARMA2/CARD14 in NF-kB activation signalling
- Caratterizzazione delle specie ittiche di basso valore commerciale del Golfo di Manfredonia
- Approcci Sistemici e Transdisciplinari per la Gestione a lungo termine del Sovrappeso e dell’Obesità
Puoi scaricare gratuitamente questo riassunto in versione integrale.

