Meccanismi catalitici degli enzimi
Come abbiamo visto, gli enzimi possono aumentare la velocità delle reazioni molto più efficacemente dei catalizzatori chimici in genere, operando in condizioni blande e con un altissima specificità sia per i loro substrati che per i loro prodotti. La catalisi è un processo che determina un aumento della velocità con cui una reazione si avvicina all'equilibrio. Poiché, la velocità di una reazione è una funzione dell'energia libera di attivazione ΔG#, un catalizzatore agisce abbassando l'altezza di questa barriera cinetica; Nella maggioranza dei casi, nei meccanismi enzimatici non vi è niente di particolare rispetto a quelli non enzimatici. Ciò che fa un enzima un catalizzatore così potente sono in effetti due proprietà tra loro correlate: la specificità di legame del substrato combinata con una organizzazione strutturale ottimale dei gruppi catalitici. I tipi di meccanismi che gli enzimi utilizzano sono stati classificati come: 1)La catalisi acido-basica; 2)La catalisi covalente; 3)La catalisi di ioni metallici; 4)La catalisi elettrostatica; 5)Gli effetti di prossimità e di orientamento; 6)Il legame preferenziale dello stato di transizione.
LA CATALISI ACIDO-BASICA
La catalisi acida generale è un processo in cui il trasferimento temporaneo di un protone da un acido di Bronsted (una specie molecolare capace di donare protoni) abbassa l'energia libera dello stato di transizione di una reazione. Per esempio, la reazione non catalizzata di tautomerizzazione cheto-enolica avviene molto lentamente per l'elevata energia del suo stato di transizione con struttura simile ad un carbanione. La donazione di un protone all'atomo di ossigeno riduce il carattere di carbanione dello stato di transizione, catalizzando quindi la reazione. 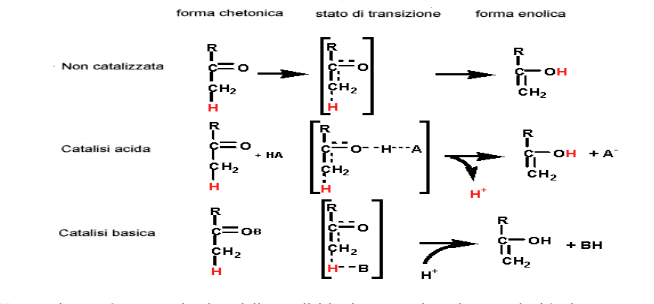
Una reazione può essere stimolata dalla catalisi basica generale se la sua velocità viene aumentata dalla sottrazione temporanea di un protone da parte di una base di Bronsted (una specie molecolare che può combinarsi con un protone). Alcune reazione possono presentare simultaneamente entrambi i processi, cioè una catalisi acido-basica generale concertata. Ad esempio, la ribonucleasi A del pancreas bovino (RNasi A) rappresenta un buon esempio di catalisi acido-basica mediata da un enzima. Questo enzima digestivo idrolizza l'RNA nei nucleotidi che lo compongono. L'RNasi possiede due residui di His, l'His 12 e l'His 119, che agiscono in maniera concertata da catalizzatori acido-basici. La reazione dell'RNasi è un processo ha due tappe:
1.L'His 12, agendo come una base generale, sottrae un protone al gruppo ossidrilico in posizione 2' dell'RNA, promuovendo quindi il suo attacco nucleofilo sull'atomo di fosforo adiacente, mentre l'His 119, agendo da acido generale, induce la scissione del legame, portando il gruppo R'—OH che esce dall'enzima per primo;
2.L'intermedio 2',3'-ciclico viene idrolizzato essenzialmente attraverso un meccanismo che è l'inverso della prima tappa, con una molecola di acqua che sostituisce il gruppo uscito. Quindi l'His 12 si comporta come un acido generale e l'His 119 come una base generale per produrre l'idrolisi dell'RNA e, alla fine, l'enzima ritorna nello stato iniziale.
Continua a leggere:
- Successivo: Caratteristiche della catalisi covalente
- Precedente: Reazioni enzimatiche a due substrati
Dettagli appunto:
- Autore: Domenico Azarnia Tehran
- Università: Università degli Studi di Roma La Sapienza
- Facoltà: Scienze Matematiche, Fisiche e Naturali
- Corso: Scienze Biologiche
- Esame: Chimica biologica
- Titolo del libro: Biochimica
- Autore del libro: Donald Voet e Judith G. Voet
- Editore: Zanichelli
- Anno pubblicazione: 1993
Altri appunti correlati:
- Fisiologia della nutrizione
- Biologia molecolare
- Biochimica
- Struttura molecolare delle proteine
- Scienze e tecniche dietetiche applicate
Per approfondire questo argomento, consulta le Tesi:
- Crescita di Chlorella vulgaris in acque reflue da vinificazione: studio della cinetica di crescita e del contenuto in lipidi
- Evidenze nutrizionali per il recupero muscolare nell'atleta di endurance
- The role of CARMA2/CARD14 in NF-kB activation signalling
- Caratterizzazione delle specie ittiche di basso valore commerciale del Golfo di Manfredonia
- Approcci Sistemici e Transdisciplinari per la Gestione a lungo termine del Sovrappeso e dell’Obesità
Puoi scaricare gratuitamente questo riassunto in versione integrale.

